L’insuffisance rénale chronique (IRC) est une maladie évolutive dans laquelle les reins perdent progressivement leur capacité à filtrer les déchets du sang. Il s’agit d’un problème de santé courant qui touche environ 8 à 16 % de la population mondiale, en particulier chez les personnes âgées. L’IRC peut avoir diverses causes, notamment la glomérulonéphrite, un groupe de maladies qui endommagent les glomérules, les minuscules unités filtrantes situées dans les reins.
Aujourd’hui, des chercheurs de l’Université de Chiba ont identifié une molécule appelée CC chemokine ligand 5 (CCL5) comme acteur clé dans les lésions rénales et leur réparation.
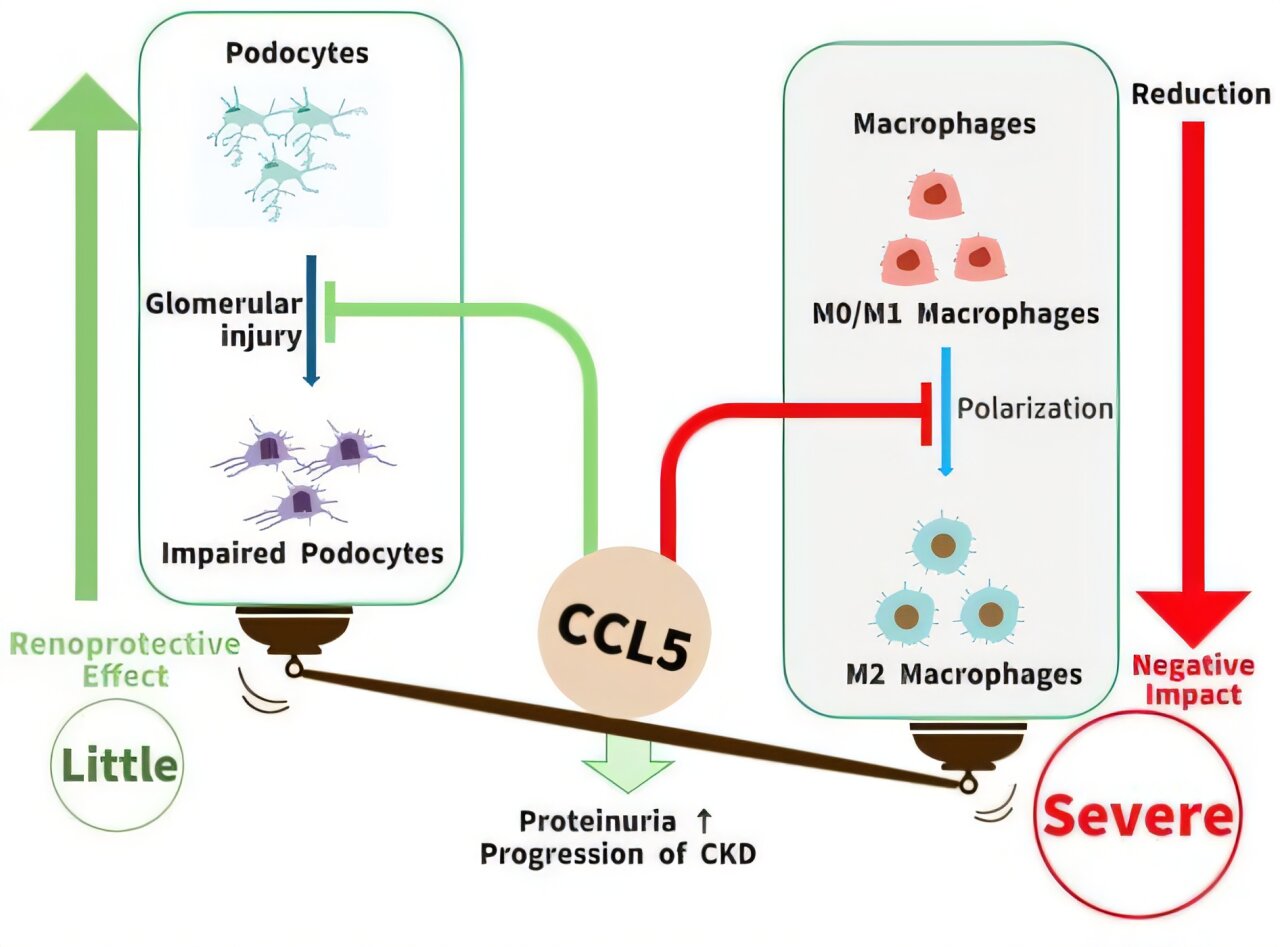
Leurs résultats révèlent que CCL5 se comporte de deux manières distinctes : il peut protéger certaines cellules rénales, appelées podocytes, qui sont des cellules spécialisées qui s’enroulent autour du glomérule et forment la dernière barrière du filtre rénal ; cependant, en même temps, cela peut aggraver les lésions rénales globales.
L’étude a été dirigée par le professeur Katsuhiko Asanuma de la faculté de médecine de l’université de Chiba, au Japon, en collaboration avec le professeur Motoko Y. Kimura et d’autres.
Leurs conclusions, publiées dans Aperçu JCIpourrait ouvrir la voie à des traitements plus précis de l’IRC.
CCL5 est une molécule de signalisation, ou chimiokine, qui aide les cellules immunitaires à se déplacer vers les sites d’inflammation. Il a été identifié pour la première fois dans les cellules T, mais des recherches ultérieures ont montré qu’il est également produit par d’autres types de cellules, notamment les cellules épithéliales autour des glomérules appelés podocytes, qui agissent comme couche finale de filtration.
En conséquence, CCL5 joue des rôles à la fois utiles et nocifs, soutenant la défense immunitaire d’une part mais favorisant l’inflammation et les lésions tissulaires d’autre part.
Des études antérieures ont produit des résultats contradictoires sur les effets du CCL5, certaines suggérant qu’il protège les reins, tandis que d’autres ont indiqué qu’il aggrave les blessures.
Pour clarifier le rôle de CCL5 dans l’IRC, l’équipe de l’Université de Chiba a analysé le tissu rénal de patients atteints de diverses maladies glomérulaires et de souris atteintes de néphropathie induite par l’Adriamycine (ADR), un modèle qui imite étroitement les troubles rénaux humains tels que la glomérulosclérose segmentaire focale.
Chez les humains et les souris, ils ont découvert que les niveaux de CCL5 étaient beaucoup plus élevés dans les glomérules endommagés et étaient étroitement liés aux podocytes, les cellules qui maintiennent la barrière de filtration.
Ensuite, les chercheurs ont mené des expériences en utilisant à la fois des podocytes cultivés en laboratoire et des souris vivantes. En laboratoire, le traitement des podocytes avec CCL5 les a aidés à survivre et à réduire la mort cellulaire, suggérant un effet protecteur. Cependant, chez les souris qui ont développé une maladie rénale, des niveaux plus élevés de CCL5 ont exacerbé les dommages, provoquant une fuite plus importante de protéines dans l’urine, davantage de cicatrices sur le tissu rénal et une perte plus importante de podocytes.
Pour comprendre pourquoi cela s’est produit, l’équipe a examiné le rôle des cellules immunitaires. Lorsqu’ils ont transplanté de la moelle osseuse provenant de souris dépourvues de CCL5 chez des souris normales, les receveurs ont présenté une réduction des lésions rénales. Cela indique que le CCL5 produit par les cellules immunitaires, plutôt que par les cellules rénales, était responsable de l’aggravation de la maladie.
Une analyse plus approfondie a montré que CCL5 favorisait les macrophages « M1 » inflammatoires tout en réduisant le nombre de macrophages « M2 » cicatrisants. En d’autres termes, cela a fait pencher la balance vers l’inflammation plutôt que vers la réparation.
« Les effets immunitaires nocifs du CCL5 l’emportent sur son rôle protecteur dans les podocytes, entraînant une protéinurie, une glomérulosclérose et une perte de podocytes », explique le professeur Asanuma.
Ces résultats mettent en évidence une nouvelle approche pour développer de futurs traitements contre l’IRC. Au lieu de bloquer largement les voies inflammatoires, les thérapies pourraient être conçues pour soutenir les mécanismes de réparation du corps tout en limitant les réponses immunitaires nocives qui provoquent des lésions rénales.
« Les connaissances acquises grâce au double rôle de CCL5 pourraient guider le développement de médicaments ciblant les cellules qui bloquent ses effets immunitaires nocifs sans interférer avec ses actions protectrices dans les podocytes. Si de telles thérapies deviennent disponibles, les patients pourraient bénéficier d’une progression plus lente de l’IRC, d’une diminution du nombre de cas nécessitant une dialyse ou une transplantation et d’une meilleure préservation de la fonction rénale et de la qualité de vie », explique le professeur Asanuma.