Les gens sont exposés à des millions de spores fongiques chaque jour, même potentiellement nocifs comme ceux d’Aspergillus fumigatus. Pour la plupart des individus, cette exposition constante est inoffensive, car le système immunitaire efface efficacement les spores sans maladie.
Cependant, pour un nombre croissant de personnes atteintes de systèmes immunitaires affaiblis en raison du cancer, des transplantations d’organes ou des maladies chroniques, les spores d’Aspergillus peuvent entraîner des infections mortelles appelées aspergillose. Ainsi, la compréhension des mécanismes immunitaires spécifiques qui luttent contre les infections fongiques est essentielle pour développer des thérapies et améliorer les résultats pour les personnes touchées.
Les scientifiques ont longtemps étudié une famille de protéines de capteurs appelées récepteurs de lectine de type C (CLR), qui sont cruciales pour détecter et éliminer les agents pathogènes. La plupart des CLR agissent comme la pédale de gaz d’une voiture, initiant de puissantes réponses immunitaires pour attaquer les microbes envahissants. Cependant, un CLR spécifique, l’immunorécepteur de cellules dendritiques (DCIR), est un immunorégulateur connu qui agit plutôt comme un frein, atténuant les réponses immunitaires. Bien que son rôle dans la limitation de l’inflammation et de l’auto-immunité soit bien documenté, sa fonction précise lors des infections fongiques reste claire.
Dans une étude récente, une équipe de recherche dirigée par le professeur agrégé Shinobu Saijo et le professeur adjoint Fabio Seiti Yamada Yoshikawa du Medical Mycology Research Center de l’Université de Chiba, au Japon, ont commis ce lac de connaissances. En utilisant des modèles de souris, l’équipe a étudié comment DCIR influence la réponse de l’hôte à Aspergillus fumigatus, en se concentrant sur la façon dont il affecte un type de cellule immunitaire clé. L’étude a été publiée dans la revue Frontières en immunologie le 4 août 2025.
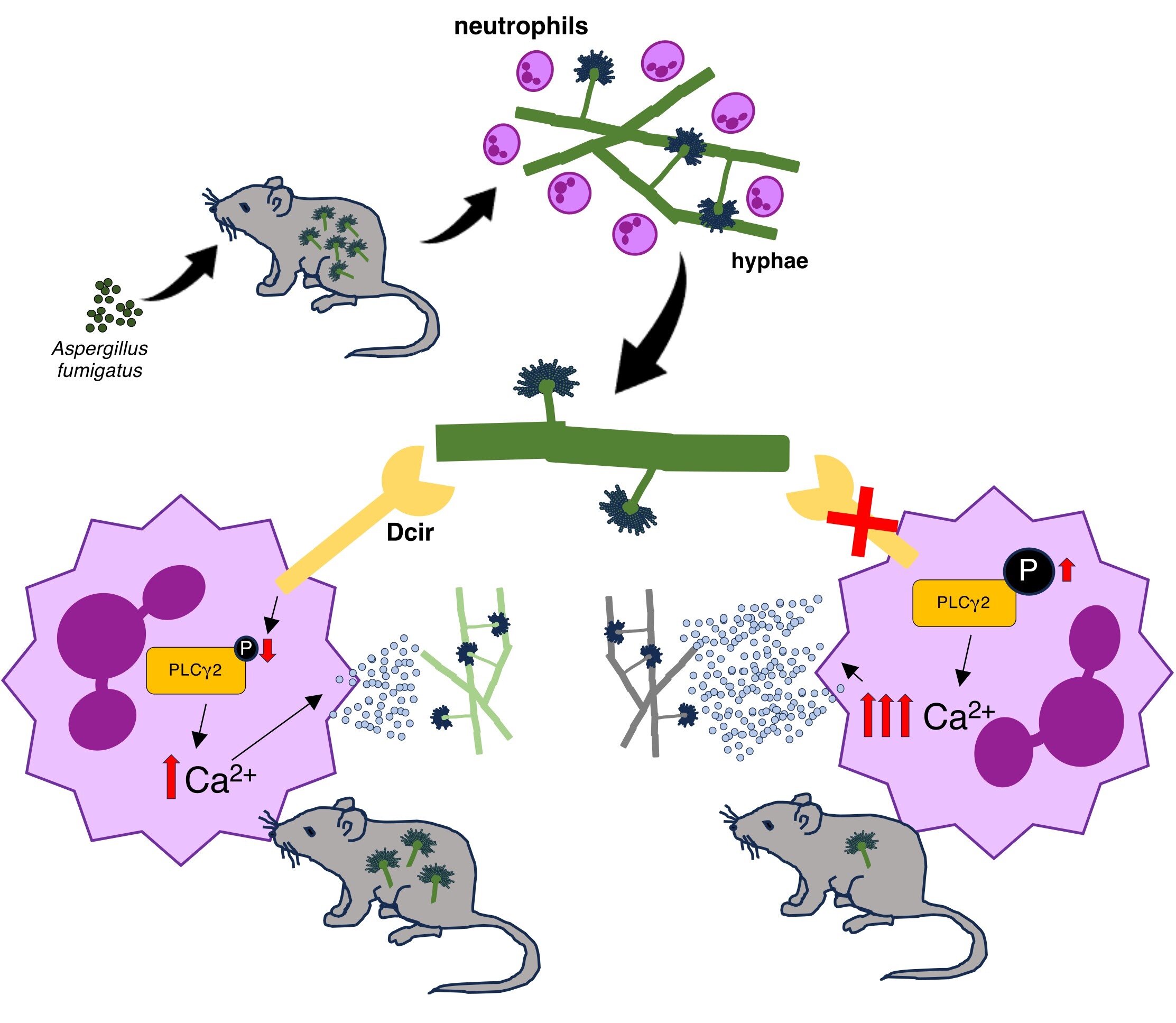
Les expériences initiales ont révélé que les souris manquant de DCIR (ou « Knikout DCIR ») étaient significativement meilleures pour nettoyer l’infection fongique de leurs poumons et de leur rate par rapport aux souris de type sauvage. Pour comprendre pourquoi l’absence de ce récepteur a amélioré la réponse immunitaire, l’équipe s’est concentrée sur les neutrophiles, qui sont les principales cellules immunitaires responsables de la lutte contre ce type d’infection. Ils ont découvert que l’effet protecteur de la carence en DCIR dépendait entièrement des neutrophiles, car épuisant ces cellules chez les souris à knock-out DCIR a éliminé la clairance fongique améliorée qu’ils avaient précédemment observée.
Les chercheurs sont ensuite passés à des expériences in vitro, pour lesquelles ils ont isolé les neutrophiles des souris DCIR-knockout. « Les neutrophiles éliminent les agents pathogènes via la phagocytose, la mort cellulaire programmée, le stress oxydatif et la dégranulation », explique le Dr Fabio Seiti Yamada Yoshikawa. « Nous avons cherché à identifier le mécanisme effecteur exact par lequel DCIR régule l’activité fongicide contre A. fumigatus. »
L’équipe a confirmé que ces neutrophiles étaient plus efficaces pour tuer des hyphes fongiques – les structures filamenteuses qui composent le corps principal du champignon – par la dégranulation. Il s’agit d’un processus puissant dans lequel les neutrophiles libèrent leur magasin interne d’enzymes, détruisant des agents pathogènes trop grands pour être engloutis.
Les neutrophiles des souris déficientes en DCIR ont présenté une activité de dégranulation significativement plus élevée, que les chercheurs ont lié à une mobilisation intracellulaire de calcium accrue et à l’activation d’une protéine de signalisation spécifique appelée PLCγ2. Inversement, lorsqu’ils ont bloqué le processus de dégranulation avec un médicament, l’effet protecteur de la carence en DCIR a disparu, à la fois in vitro et dans le modèle de la souris.
En agissant comme un régulateur négatif de la dégranulation des neutrophiles, DCIR met essentiellement un frein sur le système immunitaire, limitant son efficacité contre A. fumigatus. Dans l’ensemble, ces résultats élargissent notre compréhension des fonctions CLR dans la défense de l’hôte, mettant en évidence un niveau supplémentaire de complexité dans les interactions hôte-fungi qui pourraient être exploitées dans la pratique clinique.
« L’identification du DCIR en tant que récepteur impliqué dans la défense de l’hôte à Aspergillus fumigatus suggère qu’il peut être une cible potentielle pour les interventions pharmacologiques, aidant au traitement des patients touchés par cette infection », note le Dr Saijo. « Notre travail ouvre ainsi de nouvelles pistes d’enquête qui peuvent aider à améliorer la compréhension actuelle de l’aspergillose et de sa gestion. »
Des recherches supplémentaires se concentreront sur la question de savoir si les variations génétiques du gène DCIR sont associées à la gravité de l’aspergillose chez l’homme et sur l’identification des molécules spécifiques sur Aspergillus que DCIR reconnaît. Avec un peu de chance, ces efforts conduiront finalement à de meilleures options pour ceux qui sont plus à risque d’infection fongique.