Plus de 30 millions d’Américains comptent sur des dispositifs médicaux implantés comme les articulations prothétiques, les stimulateurs pacemakistes et plus pour améliorer leur qualité de vie. Mais implanter tout objet étranger dans le corps comporte également le risque d’introduire des infections fongiques mortelles.
De nouvelles recherches des scientifiques de l’Université de Géorgie découvrent comment une protéine de régulateur de transcription pour le pathogène fongique Candida albicans coordonne un ensemble diversifié de gènes pour infecter les dispositifs médicaux du corps humain. L’étude est publiée dans la revue Microbiologie de la nature.
Candida albicans est généralement une levure inoffensive couramment trouvée dans le corps humain. Mais la prolifération du champignon peut entraîner des infections à levures, le muguet ou même la candidose invasive potentiellement mortelle qui peut entraîner une défaillance des organes.
Les dispositifs médicaux qui peuvent potentiellement abriter des infections comprennent les cathéters, les stimulateurs cardiaques, les vannes cardiaques artificielles et les articulations prothétiques.
« Les taux d’infection globaux varient … mais oscillent environ 500 000 à 1 million par an aux États-Unis », a déclaré Aaron Mitchell, auteur principal de l’étude et professeur de recherche distingué au UGA Franklin College of Arts and Sciences Department of Microbiology.
Les biofilms sur les dispositifs médicaux présentent un risque d’infection
Les dispositifs médicaux fournissent une surface attrayante pour que les micro-organismes s’accrochent, et une fois que ces biofilms se forment, ils sont difficiles à percer.
Les biofilms libèrent des cellules qui infectent les tissus profonds et ne répondent souvent pas au traitement antifongique.
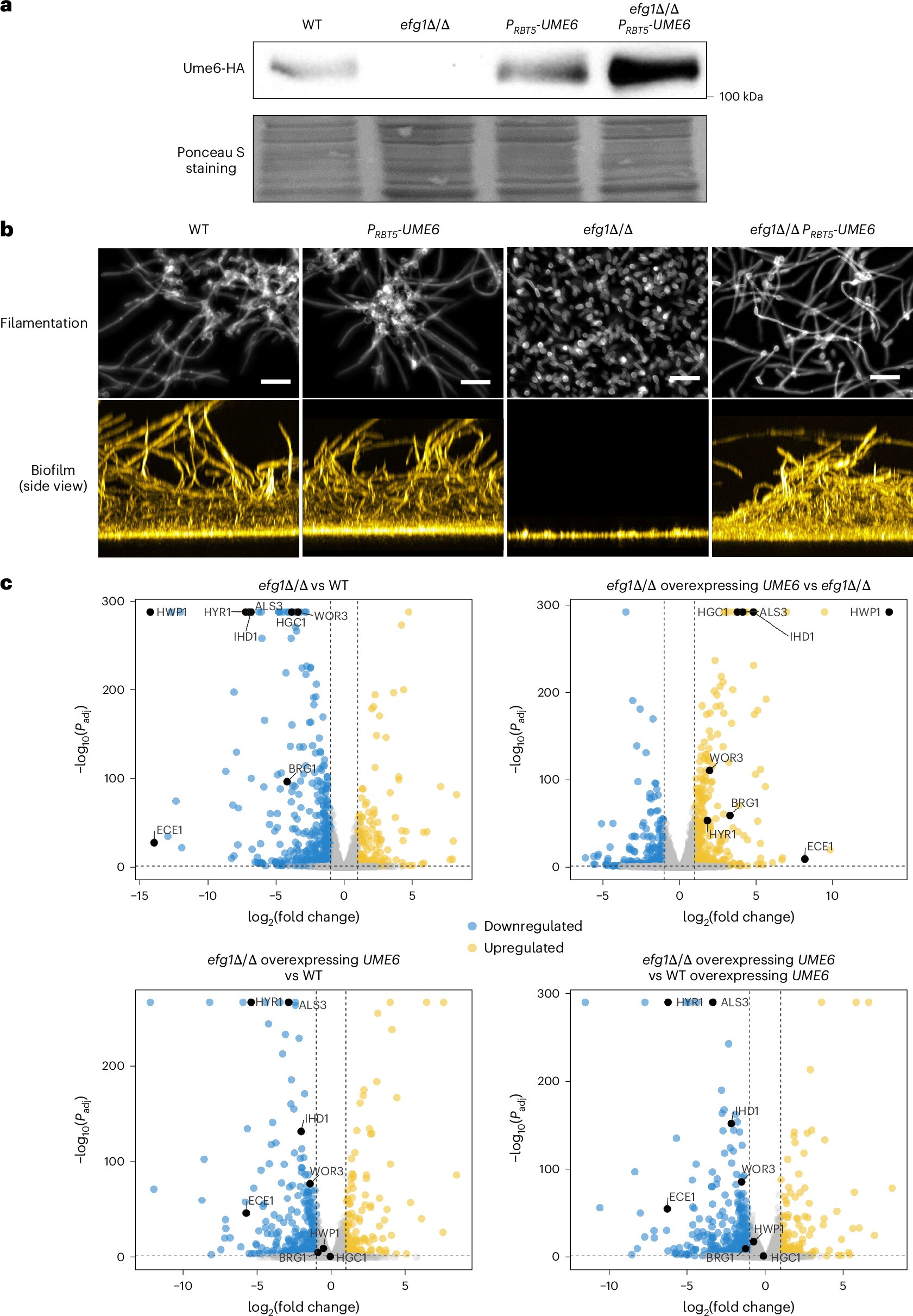
Dans le cas de Candida albicans, la formation de biofilm nécessite la coordination des ensembles de gènes pour l’adhésion, le développement et la maturation des cellules, et pour la croissance dans des conditions à faible teneur en oxygène. La nouvelle étude montre que les complexes protéiques du facteur de transcription UME6 coordonnent l’expression de ces ensembles de gènes.
Les nouvelles résultats se concentrent sur la protéine UME6, qui peut être considérée comme un auto-stoppeur qui interagit avec d’autres protéines pour atteindre sa destination.
« Pensez aux biofilms microbiens moins comme un film et plus comme une enveloppe de cuisine qui permet à une communauté de cellules de rester ensemble et d’adhérer souvent à une surface si l’on est présent, comme dans le cas d’un appareil implanté », a déclaré Mitchell.
« Nos résultats ici expliquent pourquoi l’UME6 est si efficace pour conduire le biofilm et la formation hypha: ses cibles directes incluent de nombreux gènes connus pour être nécessaires pour ces processus. »