Un groupe de cellules nerveuses connues pour leur rôle dans la détection de l’irritation chimique, des dommages aux tissus, de la chaleur et de la pression émerge désormais comme des défenseurs critiques contre les pires ravages de la grippe provoqués par une réponse immunitaire hyperactive, selon de nouvelles recherches de scientifiques de la Harvard Medical School et de la Harvard Th Chan School of Public Health.
Les cellules, appelées nocicepteurs vagaux Trpv1, vivent dans le nerf vague, qui envoie des signaux d’organes internes – y compris le cœur, les poumons et l’intestin – au cerveau pour aider à réguler la fréquence cardiaque, la respiration, la digestion et d’autres fonctions. Dans les poumons, ces cellules déclenchent le réflexe de toux protecteur qui oblige les voies respiratoires à expulser les particules étrangères, le mucus et d’autres irritants.
Mais la recherche, publiée dans Immunologie scientifique Et menés chez la souris, montre que dans le cadre de la grippe, ces cellules font beaucoup plus – elles réduisent le système immunitaire et évitent l’inflammation qui fumait qui se produit souvent au lendemain d’une infection virale et peut blesser les tissus sains.
Chaque année, la grippe rend les millions et tue entre 290 000 et 650 000 personnes dans le monde, selon l’Organisation mondiale de la santé. Bien que le système immunitaire aide à combattre le virus, une réponse inflammatoire excessive peut infliger des dommages tissulaires et aggraver la maladie. Les résultats sont particulièrement pertinents dans le sillage de la pandémie Covid-19, ce qui a révélé comment une réponse immunitaire aberrante après une infection virale peut parfois entraîner de graves dommages aux organes et même une insuffisance organique.
« Nos recherches montrent que le poumon infecté est un champ de bataille où les nerfs et les cellules immunitaires s’engagent dans une danse délicate pour sauvegarder notre santé », a déclaré la co-ennior, auteur Isaac Chiu, professeur d’immunologie au Blavatnik Institute du HMS. « Comprendre cet axe de signalisation neuro-immune puissant sera de plus en plus important car nous concevons de meilleures façons de prévenir et de traiter les dommages à médiation immunitaire dans les infections virales, ce qui peut parfois être pire que les dommages directs causés par le virus lui-même. »
Les résultats, a-t-il ajouté, soulèvent la possibilité que la fonction du nerf vague puisse être une variable qui explique pourquoi certaines personnes atteintes de grippe continuent de développer des dommages à l’immunité de longue durée et dévastateurs dans leurs poumons tandis que d’autres se rétablissent une fois l’infection initiale résolue.
« Les infections à la grippe sont très variables en gravité et il est nécessaire de comprendre pourquoi certains groupes de personnes, tels que les personnes âgées, souffrent d’une maladie pire », a déclaré la première auteur de l’étude, Nicole Almanzar, doctorante au Chiu Lab. « Notre étude démontre que le système nerveux est activement impliqué dans la régulation de la réponse des poumons à l’infection, offrant une nouvelle perspective sur les infections virales qui pourraient aider à expliquer pourquoi des facteurs particuliers augmentent le risque d’infections graves. »
La nouvelle étude éclaire l’interaction complexe entre le corps et le cerveau et ajoute à un ensemble croissant de recherches montrant que les systèmes nerveux et immunitaire se livrent à une diaphonie très orchestrée pendant l’infection pour moduler les défenses corporelles.
Des recherches antérieures menées par Chiu ont révélé l’interaction complexe entre les deux systèmes dans la pneumonie bactérienne, la maladie mangeuse de chair, la méningite, la douleur et les démangeaisons.
L’une des études antérieures de Chiu a révélé que lors des infections bactériennes du poumon, le même ensemble de neurones nerveuses vagaux a supprimé les défenses immunitaires. Dans la nouvelle étude, cependant, la fonction de mise en œuvre immunitaire de ces cellules a travaillé pour protéger le poumon des dommages excessifs pendant l’infection virale.
« Le contexte est clairement important », a déclaré Chiu.
Désactivation des neurones a aggravé les dommages à la grippe dans les poumons
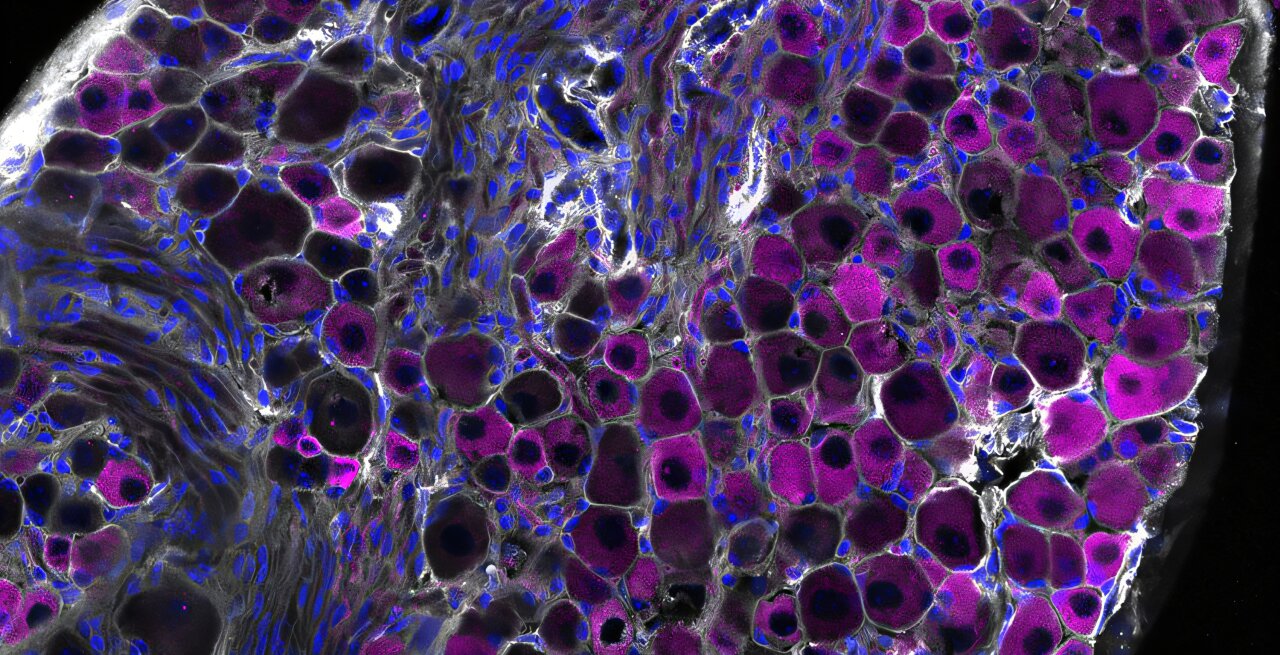
Dans un ensemble d’expériences, les chercheurs ont exposé un groupe de souris avec des neurones TRPV1 génétiquement handicapés ou chimiquement silencieux au virus de la grippe A. Les souris sans ces cellules nerveuses se sont complétées notamment pires que les souris avec des cellules TRPV1 fonctionnant. Même si la quantité globale de virus dans les poumons était la même dans les deux groupes, les souris dépourvues de neurones TRPV1 ont souffert de pathologie pulmonaire plus sévère, de niveaux plus élevés d’inflammation nocive et de taux de survie plus faibles.
Fait intéressant, Almanzar a noté, même si la charge virale globale est restée la même, la propagation du virus dans les lobes des poumons était plus prononcée chez la souris sans ces neurones protecteurs.
Les chercheurs ont également constaté que l’absence de neurones TRPV1 modifiait le paysage immunitaire du poumon. Les poumons des souris dépourvus de ces neurones avaient une surabondance de neutrophiles et de macrophages – deux types de cellules immunitaires qui – en excès – peuvent aggraver les dommages tissulaires. Dans le même temps, la signalisation de l’interféron – l’une des voies de défense virale les plus importantes du corps – a été gravement altérée dans ces cellules immunitaires.
Dans une autre expérience, les chercheurs ont utilisé un anticorps pour épuiser les cellules de conduite d’inflammation chez des souris infectées par la grippe dépourvues de neurones TRPV1. Ces animaux avaient notamment une meilleure survie que les souris non traitées dépourvues de ces neurones protecteurs. L’observation souligne en outre comment les cellules nerveuses aident à prévenir les réactions immunitaires nocives qui peuvent parfois être plus dangereuses que le virus lui-même.
Les chercheurs ont noté qu’ils ne savaient pas encore précisément comment les neurones TRPV1 réduisent la marche des cellules inflammatoires au niveau moléculaire – une question qu’ils prévoient d’explorer dans les travaux ultérieurs.
« Le nerf vague contrôle puissamment l’inflammation, mais la façon dont elle le fait reste un mystère à résoudre », a déclaré Chiu. « Mais nous sommes ravis que cela joue un rôle si fort dans les infections virales. »
Exploitation du frein immunitaire pour la thérapie
À l’avenir, cette idée ouvre la porte à de nouvelles avenues passionnantes pour la thérapie. Au lieu de cibler uniquement le virus de la grippe ou d’amortir l’activité immunitaire, l’équipe de recherche a déclaré que les traitements futurs pourraient imiter la fonction des cellules nerveuses pour garantir que l’équilibre délicat entre les réponses immunitaires protecteurs et dommageables ne soit pas éteinte.
L’idée n’est pas si farfelue, ont déclaré les chercheurs, notant que la FDA a récemment approuvé une thérapie pour la polyarthrite rhumatoïde par stimulation du nerf vague.
« Imaginez si vous pouviez exploiter ce frein pour contrôler l’inflammation dans les poumons et au-delà », a déclaré Chiu. « En stimulant les circuits apparentés où le nerf vague ferme les cellules immunitaires, on pourrait envisager de traiter le dysfonctionnement à médiation immunitaire de nombreuses sortes, y compris celle causée par des infections virales. »