Le paludisme cérébral tue 1 enfant sur 5 qui en souffre et provoque des handicaps à long terme dans la moitié des survivants. Le paludisme est causé par le parasite Plasmodium falciparum, qui se reproduit dans nos globules rouges, puis les éclate pour continuer à infecter de nouvelles cellules. Une fois que le parasite est atteint de la barrière hémato-encéphalique (BBB), une structure qui protège le cerveau des substances nocives, il est capable de l’endommager, provoquant de graves complications.
Désormais, les chercheurs d’EMBL Barcelone ont créé un BBB cultivé en laboratoire pour montrer comment le parasite les endommage, et a testé avec succès des thérapies potentielles qui pourraient aider à prévenir ou même inverser les dommages. L’œuvre a été publiée dans la revue Communications de la nature.
« Vous devez imaginer le BBB comme un système de tuyaux étroitement scellés qui empêchent les fuites. Le parasite du paludisme est capable de développer des fissures dans ces tuyaux, et de créer une fuite qui commence à dégouler du liquide dans le cerveau, provoquant un gonflement et une maladie irréversible », le groupe Bernabeu de Livia, le groupe de Bernabeu de Bernabeu et de l’étude d’Embelone de Barcelone.
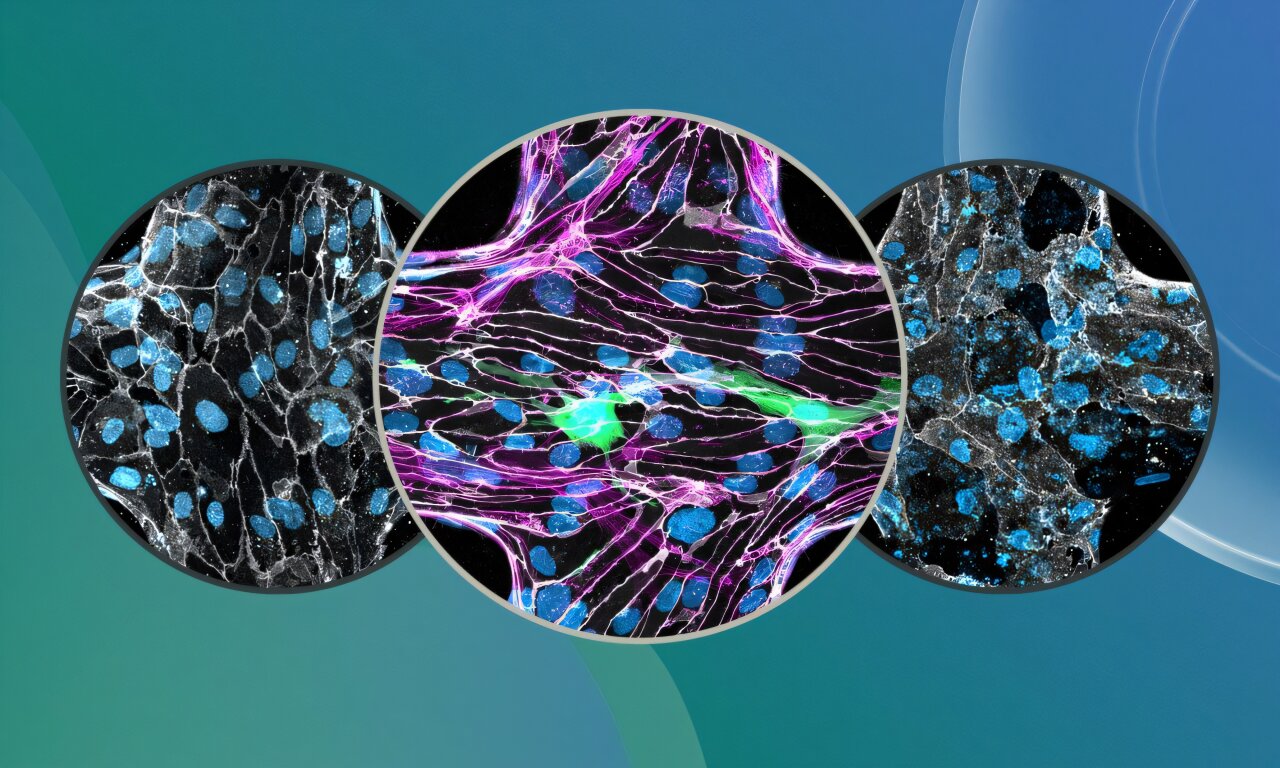
Pour comprendre comment P. falciparum est capable d’endommager la barrière, le groupe Bernabeu a construit le modèle d’infection cultivé le plus complet du BBB humain à ce jour. Il comprend les principaux acteurs cellulaires: cellules endothéliales qui tapissent les vaisseaux sanguins, soutenant les péricytes et les astrocytes, qui sont des cellules cérébrales en forme d’étoile, toutes disposées dans une structure 3D avec du fluide fluide.
Ce BBB-on-a-A-Chip (3D-BBB) a ensuite été exposé au parasite à son stade le plus explosif: le moment où il éclate des globules rouges dans un processus appelé USGRESS.
« Pour évaluer les perturbations de la barrière, nous avons utilisé une approche d’imagination en direct qui a suivi les molécules fluorescentes qui fuyent de l’intérieur des navires à la zone environnante. Lorsque nous avons appliqué des produits de sortie parasite ou des globules rouges infectés, nous avons observé une augmentation significative du passage Tracer, indiquant que la barrière était devenue plus perméable », a déclaré Alina Batzilla, baws-bourse de Bernabeu dans le groupe de Bernabeu et de l’étude de l’étude.
De plus, l’analyse de l’expression des gènes au niveau unique a montré que les cellules produisaient moins de protéines qui maintiennent le BBB scellé et plus des molécules qui provoquent une inflammation.
Cette étude montre non seulement comment et quand le parasite du paludisme endommage le BBB, mais il pointe également dans le sens du traitement. Les chercheurs ont testé avec succès un médicament approuvé, le ruxolitinib, sur leur modèle 3D-BBB, avec des résultats suggérant qu’il pourrait être efficace pour les cas mortels de paludisme.
Le ruxolitinib est un inhibiteur de la voie de signalisation JAK-Stat, qui active une réponse immunitaire, généralement liée à l’inflammation. Dans cette étude, le blocage de la signalisation JAK-Stat avec le ruxolitinib a agi comme un patch pour arrêter les gouttes des tuyaux fissurés du BBB. En aidant à calmer l’inflammation dans les vaisseaux sanguins du cerveau, le médicament a réduit la fuite du BBB.
« Notre modèle 3D-BBB est l’un des plus avancés à ce jour, mais nous voulons aller plus loin », a déclaré Maria Bernabeu, chef de groupe et auteur senior de l’étude. « Notre prochaine étape consiste à inclure les cellules immunitaires et les types de cellules supplémentaires présents dans le cerveau, comme la microglie et les neurones. Cela améliorera la complexité du modèle pour le rendre aussi similaire que possible au cerveau réel. »