Une nouvelle recherche de l’Université du Wisconsin-Madison révèle que le dysfonctionnement d’une protéine essentielle au maintien de la stabilité de nos chromosomes peut être responsable de maladies graves, voire mortelles.
Leurs conclusions, publiées dans Sciencepourrait fournir aux patients et à leurs médecins de nouvelles mutations protéiques pour tester certains cancers et maladies de la moelle osseuse.
Nos chromosomes (groupes de protéines et d’ADN qui stockent toutes nos informations génétiques) sont protégés de la dégradation par des télomères, les capuchons protecteurs aux extrémités des chromosomes constitués de séquences d’ADN et de protéines répétitives. Bien que les télomères raccourcissent naturellement avec l’âge, un dysfonctionnement de la formation et de la maintenance des télomères peut rendre l’ADN moins stable, entraînant un vieillissement prématuré et d’autres maladies.
Les scientifiques du laboratoire de Ci Ji Lim, professeur de biochimie à l’UW-Madison, en collaboration avec des chercheurs du département de chimie de l’université, se sont intéressés à l’identification de protéines qui interagissent avec une enzyme appelée télomérase, responsable du maintien des télomères. Des dysfonctionnements de ces protéines pourraient être à l’origine de certaines maladies résultant du raccourcissement des télomères.
« Cette ligne de recherche va au-delà de la compréhension biochimique d’un processus moléculaire. Elle approfondit la compréhension clinique des maladies des télomères », explique Lim.
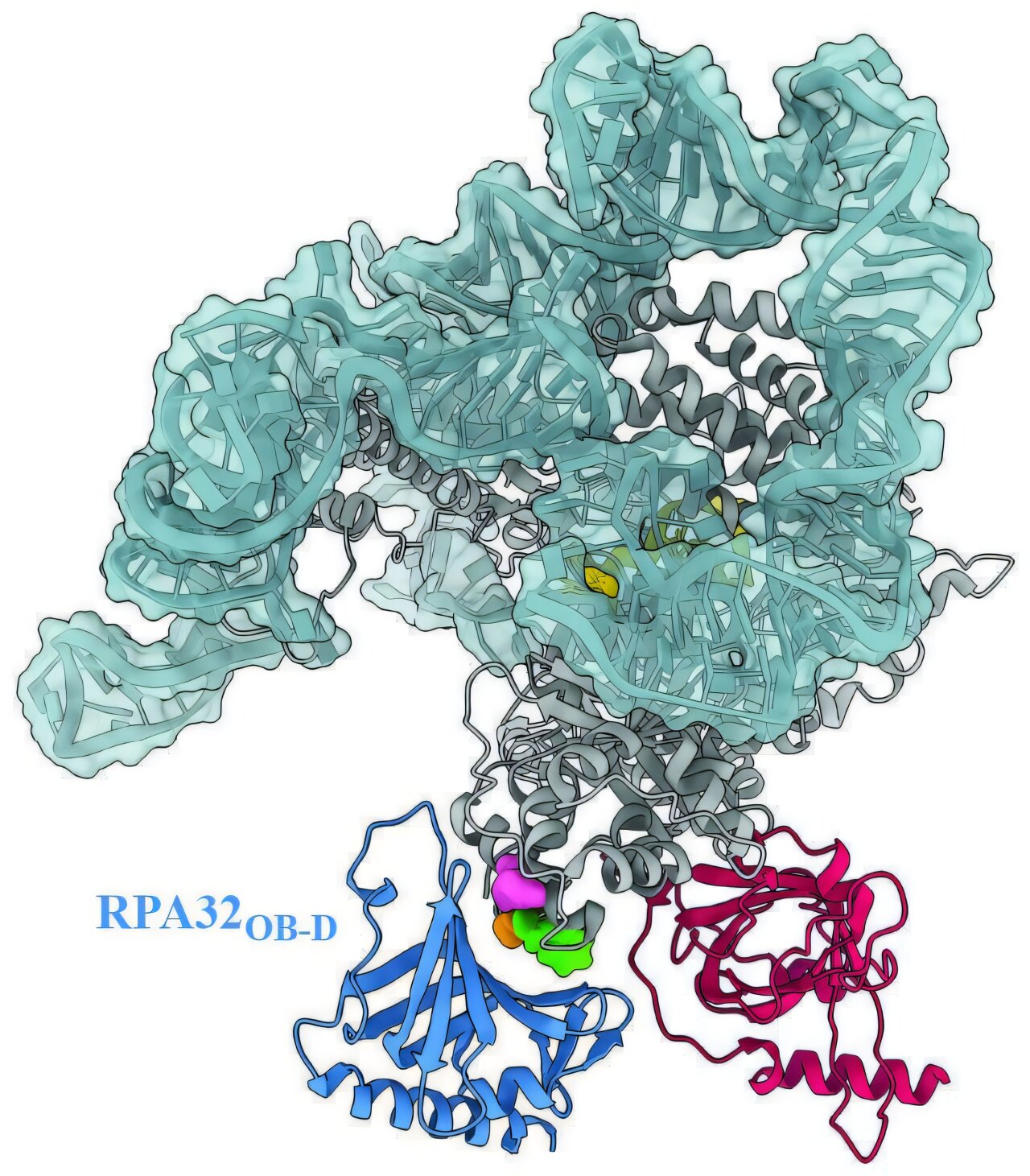
Les chercheurs, dirigés par l’étudiant diplômé Sourav Agrawal, le chercheur Xiuhua Lin et le chercheur postdoctoral Vivek Susvirkar, ont recherché des protéines susceptibles d’interagir avec la télomérase à l’aide d’AlphaFold, un outil d’apprentissage automatique qui prédit la structure 3D des protéines et les interactions protéine-protéine.
Ils ont découvert qu’une molécule appelée protéine de réplication A (RPA) joue un rôle essentiel dans le maintien des télomères en stimulant la télomérase.
Le rôle de la RPA dans la réplication et la réparation de l’ADN est compris depuis longtemps, mais son rôle dans le maintien de télomères longs et sains chez l’homme n’était pas confirmé auparavant. Guidée par les résultats d’AlphaFold, l’équipe a validé expérimentalement que, chez l’homme, la RPA est nécessaire pour stimuler la télomérase et aider à maintenir les télomères.
Leurs découvertes, dit Lim, ont des implications immédiates pour certains patients souffrant de maladies souvent mortelles résultant de télomères raccourcis, notamment l’anémie aplasique, le syndrome myélodysplasique et la leucémie myéloïde aiguë.
« Certains patients présentent des troubles des télomères raccourcis qui ne pouvaient pas être expliqués avec nos connaissances antérieures », explique Lim. « Nous avons maintenant une réponse à la cause sous-jacente de certaines de ces mutations de la maladie des télomères courts : c’est le résultat de l’incapacité de la RPA à stimuler la télomérase. »
Lim et son équipe ont reçu des demandes de cliniciens et de scientifiques du monde entier demandant si les maladies de leurs patients pourraient être le résultat de mutations génétiques inhibant la nouvelle fonction de la RPA.
« Il y a des collègues de France, d’Israël et d’Australie. Ils veulent juste donner une cause à la maladie des télomères courts de leur patient afin que les patients et leurs familles puissent comprendre ce qui se passe et pourquoi », explique Lim.
« Grâce à l’analyse biochimique, nous pouvons tester la mutation de leurs patients pour voir si elle a un impact sur la manière dont la RPA interagit avec la télomérase et donner aux médecins un aperçu des causes possibles des maladies de leurs patients. »