L’alpha-1-antitrypsine est un soi-disant inhibiteur de la protéase, un type d’inhibiteur enzymatique. Il est produit dans le foie mais exerce ses effets dans les poumons, où il régule l’activité des cellules immunitaires. Ce règlement est crucial et une réponse immunitaire hyperactive peut provoquer de graves maladies pulmonaires.
Cependant, certains individus portent une mutation génétique qui fait que la protéine alpha-1 se replie incorrectement. En conséquence, trop peu d’alpha-1 fonctionnel est produit et des quantités insuffisantes atteignent les poumons.
La mutation est héritée de l’un ou des deux parents. Environ 1 personne sur 20 en Europe porte la forme hétérozygote de la mutation – héritée d’un seul parent – et ne présente souvent aucun symptôme ou seulement des légers. En revanche, la forme homozygote plus rare, héritée des deux parents, affecte environ 1 individus sur 2 000 et est beaucoup plus grave.
Ces patients présentent un risque plus élevé de développer non seulement une maladie pulmonaire, comme une maladie pulmonaire obstructive chronique (MPOC), mais aussi des complications hépatiques, y compris une fibrose sévère ou même des tumeurs.
Une mutation, des chemins divergents
Une équipe de recherche internationale dirigée par Matthias Mann à l’Institut de biochimie Max Planck de Max Planck à Martinsried, près de Munich, a maintenant découvert de nouvelles perspectives importantes sur la forme homozygote de la condition. Les résultats sont publiés dans la revue Nature.
Le premier auteur Florian Rosenberger, du Département de la protéomique et de la transduction du signal, explique: « Dans la forme homozygote, quelque chose de frappant se démarque. C’est une maladie monogénétique, ce qui signifie que tous les patients portent la même mutation – donc en théorie, la progression de la maladie devrait être uniforme. Mais ce n’est pas ce que nous voyons.
« Un tiers des patients développent une fibrose hépatique sévère, où le tissu conjonctif s’accumule et altère la fonction hépatique. Les deux tiers, cependant, restent en bonne santé. Nous voulions comprendre pourquoi. Quels mécanismes moléculaires protègent certains patients tandis que d’autres développent une maladie? »
L’équipe a utilisé une technique appelée protéomique visuelle profonde, s’est développée en collaboration à Martinsried et à Copenhague par les groupes de recherche protéomique de Matthias Mann. Cette méthode applique une analyse avancée du protéome pour identifier les mécanismes de la maladie. Pour l’étude Alpha-1, des échantillons de tissus hépatiques de patients en Allemagne et au Danemark ont été analysés.
« Nous avons examiné les tissus à travers le spectre complet des étapes de la maladie », poursuit Rosenberger. « Même aux premiers stades – lorsque les signes cliniques n’étaient pas encore apparus – nous pouvions observer comment le corps dans certains cas a réussi à interrompre la progression de la maladie. »
Pour leur analyse, les chercheurs ont utilisé un réseau neuronal convolutionnel (CNN) – une forme d’intelligence artificielle formée à l’origine pour reconnaître les visages et les objets quotidiens dans les images.
Différences subtiles avec de gros impacts
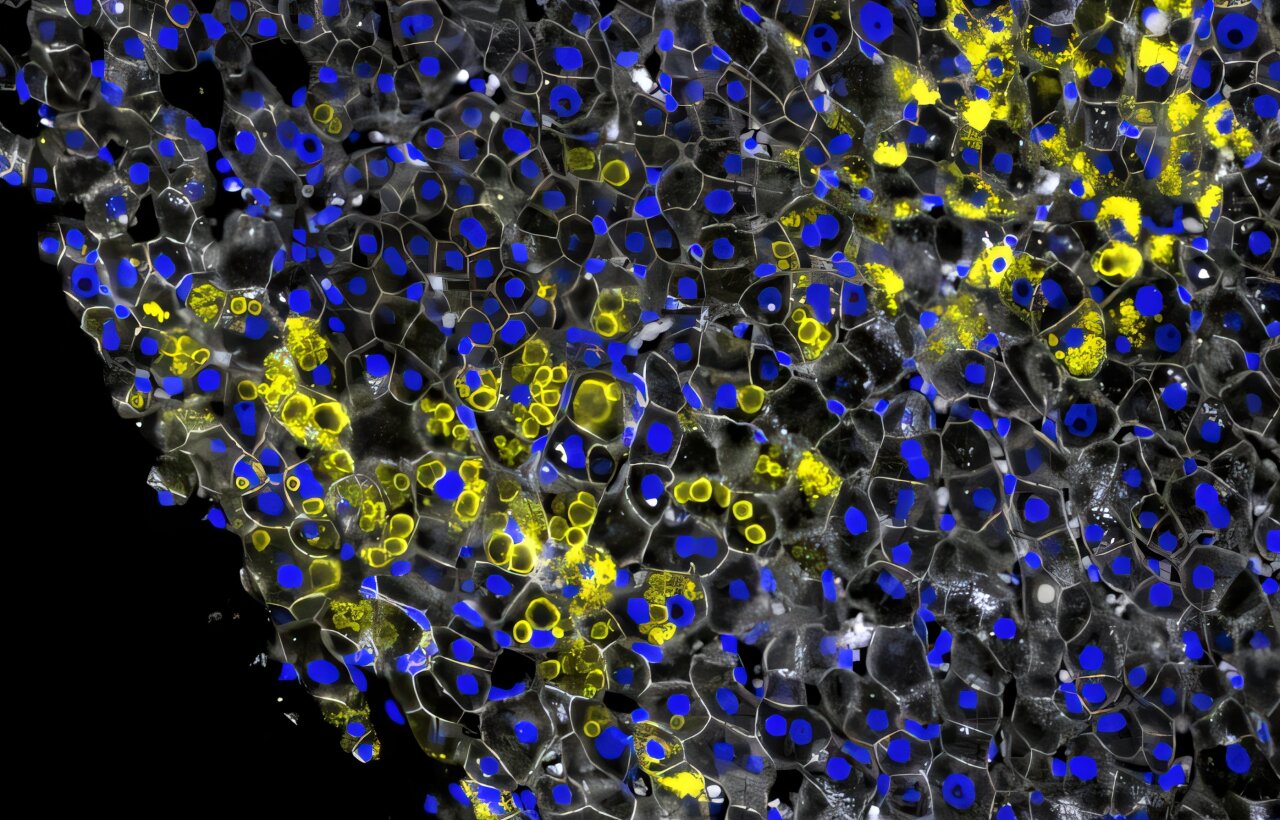
Le CNN a également effectué de manière impressionnante sur des images de tissu hépatique humain. Il a été capable de différencier les variations structurelles subtiles de la maladie, en particulier la façon dont les protéines alpha-1 agrègent dans les cellules hépatiques (hépatocytes). Ces agrégats sont une caractéristique du début de la maladie. « Notre CNN pourrait détecter des différences extrêmement fines dans la morphologie globale », explique Rosenberger.
Deux formes distinctes se sont démarquées: des agrégats en forme de mie avec une structure rugueuse et irrégulière et des agrégats en forme de balle avec une apparence plus définie. Cela a soulevé une question clé: qu’est-ce qui détermine quel type apparaît – et sont-ils aléatoires ou significatifs biologiquement?
C’est là que l’équipe a fait une percée. Ils ont réussi à reconstruire la séquence d’événements moléculaires – la formation de miettes, de balles et des transitions entre eux – et ont identifié leur ordre temporel.
Les agrégats en forme de mie sont apparus en premier, comme une réponse précoce des cellules stressées. Ceci était associé à l’activité dans les compartiments cellulaires spéciaux appelés peroxysomes. Les agrégats en forme de balle ont émergé plus tard, lors de stades de fibrose plus avancés.
Fait intéressant, cependant, le type d’agrégat n’était pas toujours en corrélation avec la gravité de la maladie. Même les patients atteints de fibrose légère pouvaient montrer la morphologie avancée de type balle. « Le passage des miettes aux balles a été une découverte clé », explique Rosenberger. « Il révèle la séquence des réponses compensatoires des cellules hépatiques dans un effort pour lutter contre la formation d’agrégats – et avec elle, la fibrose hépatique. »
Vers les applications cliniques
L’analyse d’image basée sur l’IA améliorée a joué un rôle central dans la découverte de ces mécanismes. « Les progrès technologiques récents de la spectrométrie de masse étaient cruciaux », explique le professeur Mann. « Nous pouvons désormais effectuer des mesures unicellulaires, nous permettant d’extraire des informations moléculaires détaillées à partir d’une petite quantité de tissu, même à partir de cellules hépatiques malades individuelles. »
Les résultats de l’étude pourraient bientôt avoir une pertinence clinique. Le développement de la fibrose chez les personnes atteintes de mutation homozygote pourrait potentiellement être évité.
« En examinant les antécédents des patients, nous avons vu que les personnes atteintes de fibrose sévère n’avaient pas la réponse peroxysomale précoce », explique Rosenberger. « Nous savons maintenant que cette réponse est protectrice. Notre objectif est de développer un système d’alerte précoce pour la fibrose hépatique – un moyen d’identifier les patients à risque avant la naissance des symptômes. »
Aleksander Krag, professeur à l’Université du sud du Danemark et chef du centre de recherche sur le foie d’Odense, souligne: «En capturant l’accumulation d’alpha-1 antitrypsine au niveau unique, nous avons révélé des déclencheurs moléculaires précoces de la façon dont les thérapies alpha-1 progressent.
Pavel Strnad, hépatologue à l’hôpital universitaire Aachen et collaborateur de longue date du projet, ajoute: « Le repliement erroné des protéines est au cœur de nombreuses maladies humaines, y compris la défaillance de Parkinson et Alzheimer.
« Ce travail approfondit nos informations sur les troubles du repliement des protéines et leurs conséquences, et sera important même au-delà de la carence en antitrypsine alpha-1. »