Les chéloïdes sont des cicatrices surélevées et envahissantes qui peuvent se développer après des blessures cutanées ou une intervention chirurgicale, s’étendant souvent au-delà des limites d’origine de la plaie. Pour de nombreuses personnes, les chéloïdes sont plus qu’un simple problème esthétique ; ils provoquent souvent des symptômes pénibles tels que des douleurs chroniques, des démangeaisons et une restriction des mouvements. Bien qu’il existe diverses options de traitement, telles que l’ablation chirurgicale, les injections de stéroïdes et la radiothérapie, les chéloïdes sont notoirement difficiles à gérer, avec des taux de récidive pouvant atteindre 30 %.
Même après des décennies d’études, on ne sait toujours pas pourquoi les chéloïdes se développent de manière incontrôlable, contrairement aux cicatrices hypertrophiques. On pense actuellement qu’il s’agit d’une surproduction de collagène de la matrice extracellulaire par les fibroblastes – cellules qui produisent des éléments du tissu conjonctif – et que des tensions mécaniques répétées sur la peau contribuent à la formation de chéloïdes. Cependant, les mécanismes cellulaires et moléculaires précis à l’origine de ces cicatrices incontrôlées ne sont pas clairs. Plus précisément, nous ne savons pas comment ni quelles cellules détectent la pression mécanique et la traduisent finalement en une croissance tissulaire anormale.
Or, une étude a été publiée dans le Le journal de pathologie le 1er septembre 2025, apporte une nouvelle pièce à ce puzzle. Une équipe de recherche dirigée par le professeur Yuzuru Ikehara, avec les co-premiers auteurs, le Dr Shinsuke Akita et le Dr Sanae Ikehara, et les co-auteurs, le professeur Kiyoshi Hirahara et le professeur Nobuyuki Mitsukawa, tous de la Graduate School of Medicine de l’Université de Chiba, au Japon, a étudié les différences histologiques, génétiques et moléculaires entre les chéloïdes et d’autres fibrotiques. conditions pour identifier les facteurs uniques de la formation et de la récidive des chéloïdes.
« En analysant le tissu fibreux du lymphœdème en collaboration avec des chirurgiens plasticiens, j’ai eu l’idée que sa comparaison avec le tissu chéloïde pourrait aider à identifier les altérations pathologiques spécifiques aux fibroblastes chéloïdes. Bien que les deux affections impliquent la fibrose, leurs contextes physiologiques et étiologies sous-jacents diffèrent considérablement », explique le professeur Ikehara, décrivant la motivation derrière l’étude.
L’étude impliquait une analyse complète d’échantillons de tissus humains. L’équipe a comparé les tissus chéloïdes à ceux du lymphœdème, une affection caractérisée par une prolifération fibreuse mais qui n’est pas principalement provoquée par une tension mécanique, ainsi qu’à des échantillons de peau saine. Ils ont utilisé plusieurs techniques avancées, notamment l’analyse globale de l’expression génique et le séquençage de l’ARN unicellulaire ; ces méthodes leur ont permis d’examiner l’activité des gènes dans des cellules individuelles et de caractériser avec précision les types de cellules impliqués. Grâce à cette approche détaillée, les chercheurs ont cherché à identifier les cellules et molécules mécanosensibles contribuant à la pathologie chéloïde et à sa récidive.
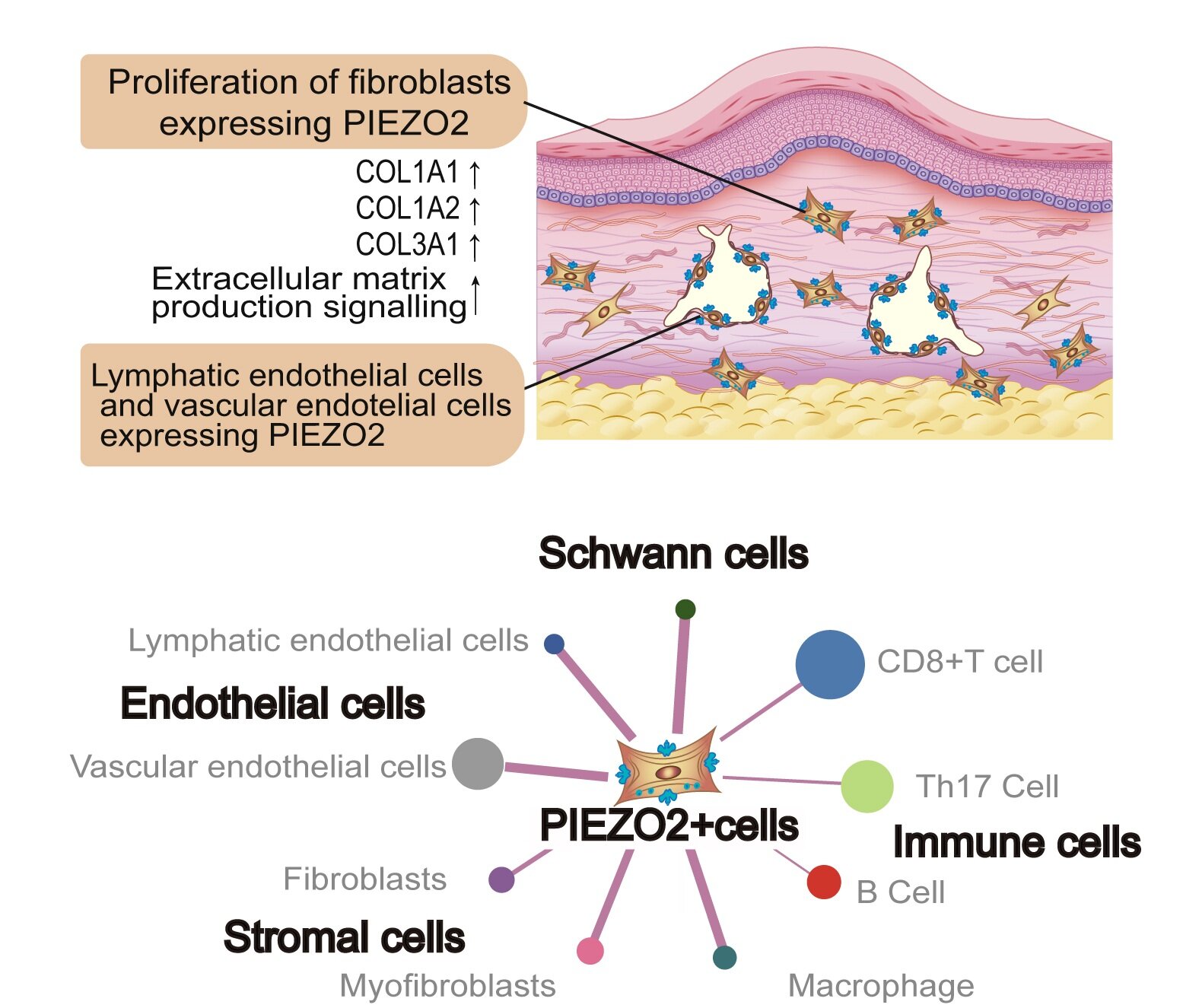
Une découverte clé a été que les tissus chéloïdes présentaient des niveaux d’expression significativement plus élevés d’un canal ionique mécanosensible appelé PIEZO2, par rapport aux tissus lymphœdèmes. En termes simples, PIEZO2 agit comme un capteur microscopique, permettant aux cellules de détecter et de répondre aux forces mécaniques. Les chercheurs ont observé que les chéloïdes ayant des antécédents de récidive après une intervention chirurgicale présentaient des niveaux encore plus élevés de PIEZO2.
Une enquête plus approfondie utilisant une analyse unicellulaire a identifié une sous-population de fibroblastes jusque-là inconnue qui exprimait spécifiquement des niveaux élevés de PIEZO2. Ces fibroblastes exprimant PIEZO2 (appelés FBPZ2+) se sont révélés très actifs dans la production de collagène et d’autres composants de la matrice extracellulaire, qui sont les éléments constitutifs du tissu cicatriciel. L’équipe a également observé que ces FBPZ2+ cellules regroupées autour des vaisseaux sanguins et lymphatiques dans les tissus chéloïdes, en particulier dans les zones en croissance active.
« Le tissu conjonctif n’est pas simplement composé de fibroblastes : il contient également des cellules immunitaires, des vaisseaux sanguins et des nerfs, qui travaillent tous ensemble pour maintenir une homéostasie adéquate, un facteur essentiel au soutien des fonctions spécifiques d’un organe », explique le professeur Ikehara.
« Par conséquent, tout comme les études sur les composants des cellules immunitaires et neurales ont fait progresser notre compréhension des maladies neurodégénératives et allergiques, l’étude des fibroblastes peut aider à découvrir les mécanismes sous-jacents à la formation des chéloïdes. » En effet, cette étude représente une étape importante dans cette direction en mettant en évidence le rôle unique de FBPZ2+cellules.
Plus important encore, l’identification de ces fibroblastes exprimant PIEZO2 a de profondes implications pour le diagnostic et le traitement futurs des chéloïdes. Les résultats de l’étude révèlent que la formation de chéloïdes n’est pas simplement une prolifération généralisée mais un processus unique piloté par des cellules spécifiques sensibles à la tension.
« Notre travail offre de nouvelles connaissances sur la pathogenèse des chéloïdes et ouvre la porte à de nouvelles stratégies diagnostiques et thérapeutiques », explique le professeur Ikehara. « Par exemple, les inhibiteurs PIEZO2, qui sont un type d’inhibiteur des canaux ioniques calciques, peuvent aider à soulager la douleur et les démangeaisons associées aux chéloïdes. Si de telles thérapies ciblées deviennent cliniquement disponibles, elles pourraient grandement améliorer la qualité de vie des patients souffrant d’inconfort lié aux chéloïdes. »
Dans l’ensemble, cette étude contribue au développement de stratégies thérapeutiques pour restaurer un tissu conjonctif sain, améliorant ainsi les résultats pour les patients.