Les chercheurs de Berlin ont utilisé l’édition de base pour réparer les mutations qui provoquent le trouble rénal ADPKD dans les cellules des souris et des humains. Chez la souris, une équipe dirigée par Michael Kaminski a pu soulager un symptôme clé de la maladie difficile à traiter.
La recherche est publiée dans Thérapie moléculaire.
Environ un enfant sur mille est né avec une maladie rénale polykystique dominante autosomique (ADPKD), ce qui en fait l’un des troubles génétiques les plus courants. La condition est généralement causée par une mutation héritée principalement dans le gène PKD1 ou PKD2. Ces mutations déclenchent la formation de kystes dans les reins, ce qui peut entraîner une pression artérielle, une douleur et des infections – et au fil du temps, à une insuffisance rénale.
« Il n’y a actuellement qu’un seul médicament approuvé pour l’ADPKD, et il traite principalement les symptômes tout en provoquant des effets secondaires graves », explique le Dr Michael Kaminski, chef du Emmy Noether Research Group Reinal Engineering au Berlin Institute for Medical Systems Biology of the Max Delbrück Center (MDC-BIMSB). Kaminski est également médecin du Département de néphrologie et de soins intensifs médicaux chez Charité – Universitätsmedizin Berlin.
Certains patients sur le médicament perdent jusqu’à six litres d’urine par jour. De plus, il ne traite pas les kystes hépatiques, à partir desquels de nombreux patients souffrent également. De nouvelles thérapies sont cruellement nécessaires.
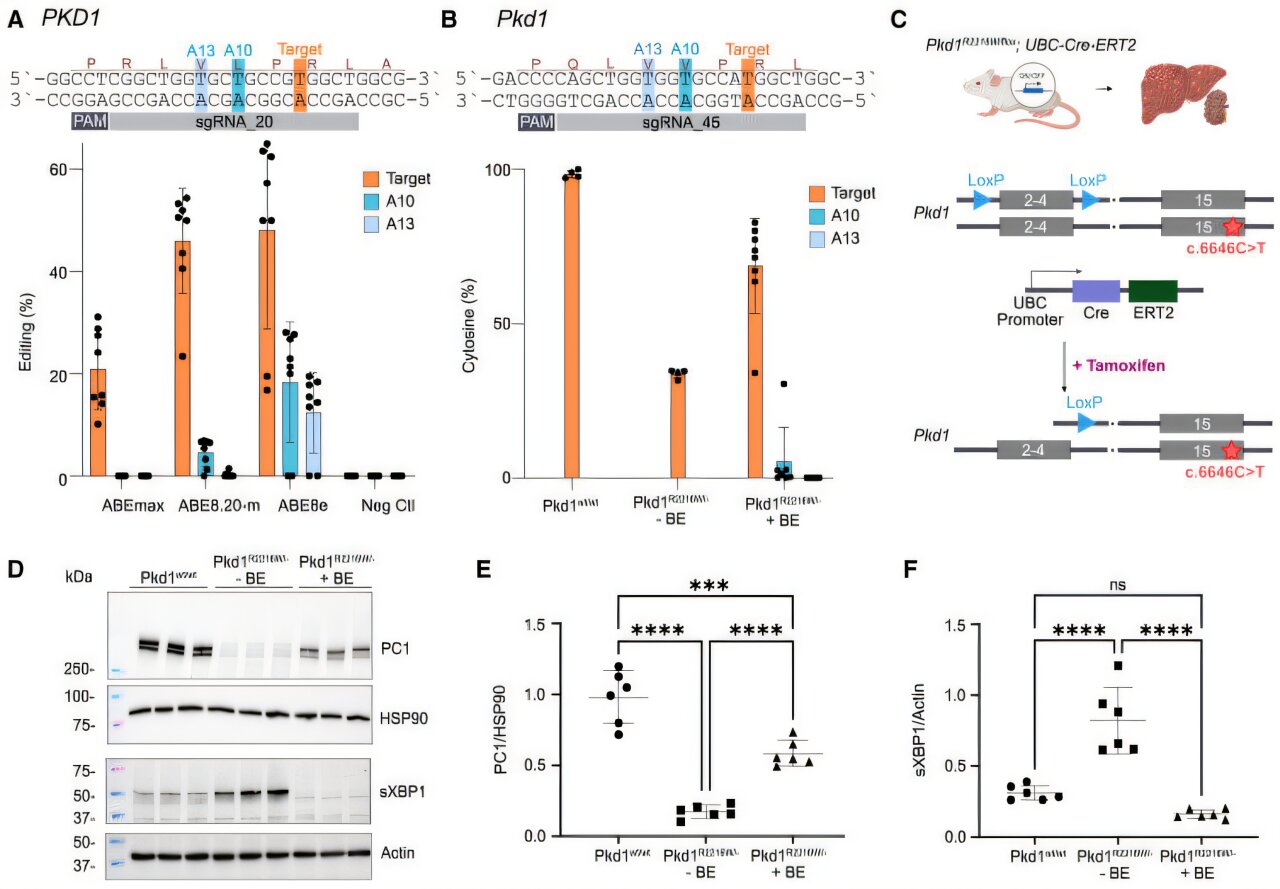
Maintenant une équipe internationale dirigée par Kaminski, le Dr Sorin Fedeles et le Dr Matteus Krappitz rapporte les progrès précoces. En travaillant avec des collègues du Max Delbrück Center, de Charité – Universitätsmedizin Berlin, de l’Université de Yale et de l’Université du Colorado, les chercheurs ont réussi à modifier l’édition de base pour corriger les mutations dans les cellules humaines et souris. Dans un modèle de souris, ils ont utilisé l’édition de base CRISPR / CAS pour réduire les kystes hépatiques.
Les co-auteurs de l’étude sont Antonia Ibel du groupe de recherche de Kaminski et du Dr Rishi Bhardwaj de la Yale School of Medicine.
Expression des protéines manquantes restaurée
Les chercheurs se sont d’abord concentrés sur l’identification des changements dans le gène PKD1 des patients ADPKD.
« Nous avons trouvé 39 mutations ponctuelles différentes, environ un tiers dont nous avons pu corriger avec une haute précision dans un système de culture cellulaire », explique Kaminski.
L’équipe a ensuite ciblé une mutation spécifique dans les cellules épithéliales rénales recueillies à partir de l’urine des patients ADPKD à Charité.
« Dans les cellules humaines et souris avec un gène PKD1 non fonctionnel, nous avons pu corriger efficacement un défaut qui provoque une protéine raccourcie en utilisant l’édition de base », explique Kaminski.
Dans les cellules de souris traitées, l’expression de la protéine polycystine-1 – codée par le gène PKD1 – a été restaurée et les niveaux d’un marqueur de stress cellulaire ont diminué.
Enfin, les chercheurs ont testé leur approche dans un modèle de souris d’ADPKD. Ils ont emballé les composants pour l’édition de base dans des virus adéno-associés et les ont livrés aux souris.
« Nous avons vu que l’éditeur de base fonctionnait particulièrement bien dans les cellules hépatiques – à la fois le nombre et la taille des kystes diminuaient considérablement », explique Kaminski. « Cela pourrait être particulièrement utile pour les patients car le seul médicament approuvé pour l’ADPKD, Tolvaptan, ne réduit pas les kystes hépatiques », ajoute-t-il.
Peu de temps si la thérapie génique fonctionne à des stades de maladie ultérieurs
Néanmoins, Kaminski n’est pas encore satisfait des résultats.
« Nous développons actuellement des systèmes de livraison pour que les outils d’édition génétique de faire plus efficacement dans le rein – au cœur du problème », dit-il. Lui et son équipe prévoient également de cibler d’autres mutations provoquant l’ADPKD et d’étudier les effets de la correction des gènes.
Une autre question ouverte est le meilleur moment pour le traitement.
« Dans notre modèle actuel, nous avons appliqué la correction de la base très tôt dans le processus de la maladie », explique Kaminski. « Je voudrais savoir si la méthode pourrait également réduire les kystes à des stades plus avancés de la maladie. »