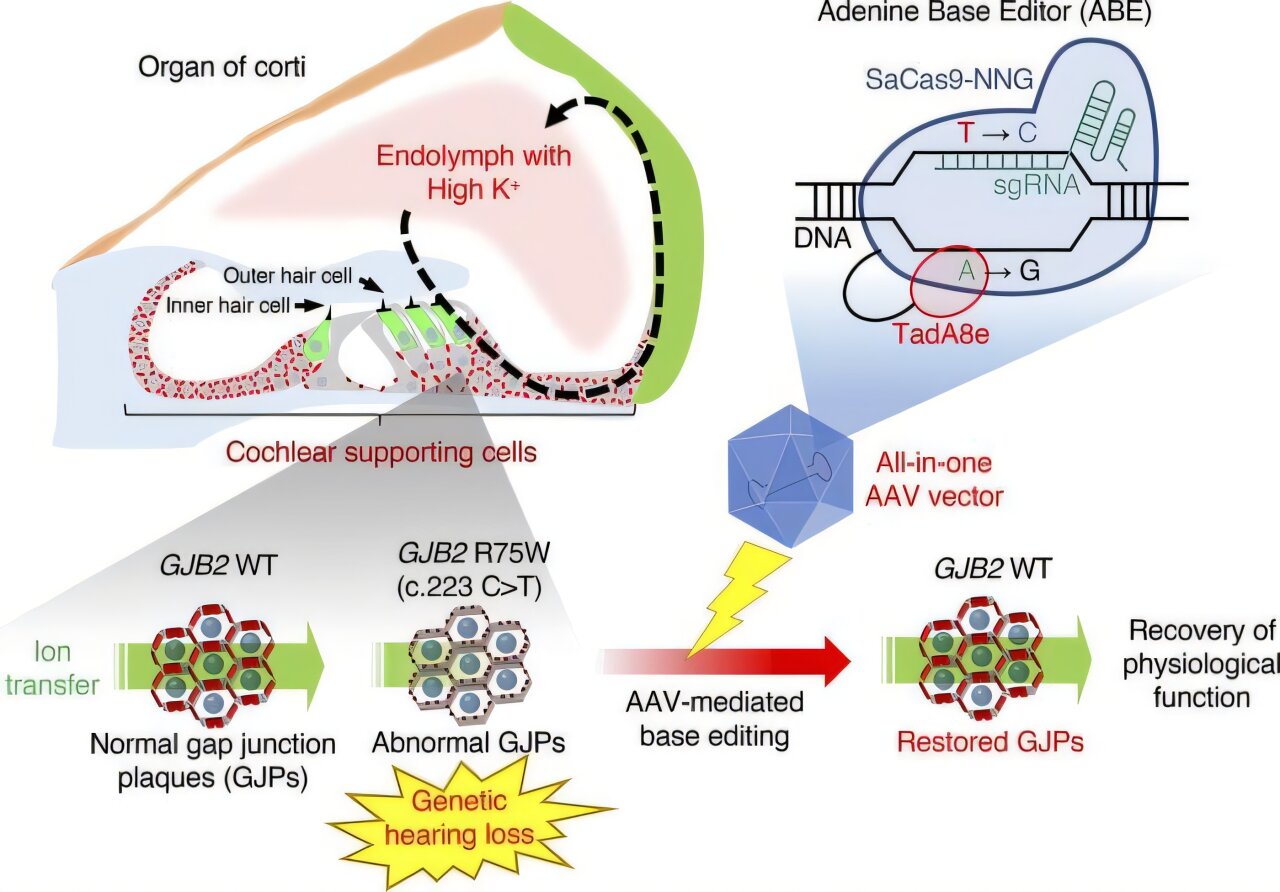
Une mutation R75W dans le gène de la jonction GAP β2 (GJB2) provoque une fragmentation sévère des plaques de jonction de l’espace, reliant les cellules adjacentes et conduisant à une perte auditive syndromique. Dans une nouvelle étude expérimentale, les scientifiques de l’Université Juntendo en collaboration avec des chercheurs de l’Université de Tokyo ont développé une approche d’édition du génome médiée par le virus ADENO-ADONO-ADONO (AAV) pour réparer la mutation R75W.
Leurs résultats, maintenant publiés dans JCI Insightpourrait contribuer au développement de thérapies géniques innovantes pour traiter la perte auditive héréditaire.
La perte auditive congénitale fait référence à une altération de la fonction auditive qui se produit en raison de causes génétiques. GJB2 est le gène responsable d’environ la moitié de tous les cas de perte auditive héréditaire. La connexine 26 (CX26), codée par GJB2, aide à la formation de jonctions intercellulaires d’écart – les canaux qui permettent le mouvement des ions et des molécules de messager chimique entre les cellules adjacentes, où il régule la fonction auditive.
Les mutations GJB2 conduisent souvent à une fragmentation des jonctions lacunaires et des plaques de jonction de lacune (GJPS) qui sont composées de CX26. Alors que l’hérédité d’une mutation GJB2 récessive contenant deux copies du gène défectueux peut être guéris fonctionnellement via le remplacement du gène GJB2, une mutation dominante négative GJB2 où la protéine mutante inhibe le fonctionnement normal de la protéine de type sauvage nécessite une approche d’édition du gène.
Des chercheurs du Japon ont développé avec succès une thérapie génique pour réparer le R75W, une mutation dominante négative de GJB2 qui provoque une perte auditive syndromique. L’équipe de recherche comprenait le professeur agrégé, le Dr Kazusaku Kamiya, et le professeur adjoint Dr Takao Ukaji au Département d’otorhinolaryngology, Juntendo University Faculty of Medicine, Japan, et le Dr Osamu Nureki du Département de sciences biologiques, Graduate School of Science, de l’Université de Tokyo, au Japon.
« L’écrasante majorité des mutations provoquant une perte auditive héréditaire implique le gène GJB2. Cependant, les traitements qui peuvent restaurer l’audition chez les patients souffrant de surdité génétique font défaut », explique le Dr Kamiya. « Nos recherches peuvent contribuer au développement de la thérapie génique pour lutter contre l’incidence croissante des patients atteints de perte auditive héréditaire. »
Premièrement, les chercheurs ont développé un AAV (AAV-SIA6E) qui peut fournir des outils d’édition de génome à une large gamme de cellules d’oreille intérieures qui forment des jonctions d’écart. L’AAV est un vecteur utile pour livrer des gènes; Cependant, la taille du gène qui peut être transportée est limitée.
Par conséquent, le Dr Kamiya et son équipe ont construit un outil d’édition de base (SACAS9-NNG-ABE8E) qui a été miniaturisé à une taille qui peut être transportée par AAV en utilisant SACAS9-NNG, qui a une taille plus petite et une efficacité d’édition du génome plus élevée que le CAS9 conventionnel. Ensuite, ils ont chargé cet outil d’édition de base sur AAV-SIA6E, qui possède un tropisme à haute infection pour les cellules de l’oreille interne et a développé un vecteur AAV tout-en-un pour l’édition du génome de l’oreille interne.
L’édition du génome via le vecteur AAV tout-en-un a montré une efficacité et une spécificité considérables. Il a montré la conversion sur le cible t à C dans les cellules humaines, exprimant la mutation GJB2 R75W, a réparé la mutation R75W et a formé un GJP clair. En outre, après la procédure d’édition de base, la fonction physiologique de la communication cellule des cellules de jonction de lacs a été restaurée.
Enfin, pour valider leurs résultats, les chercheurs ont effectué l’édition du génome médié par l’AAV dans un modèle de souris transgénique avec la mutation GJB2 R75W. Les cellules de sulcus internes de la cochlée, qui ont été infectées par le vecteur AAV tout-en-un, ont formé des GJPs distincts avec des structures pentagonales ou hexagonales disposées autour de cellules similaires à celles observées dans les cellules de type sauvage.
« En utilisant un vecteur AAV tout-en-un avec une infectivité élevée pour l’oreille interne, nous nous attendons à améliorer l’effet thérapeutique, à simplifier le processus de développement et à réduire les coûts. Kamiya.
Ensemble, ces résultats mettent en évidence l’immense potentiel thérapeutique de l’approche d’édition du génome médiée par l’AAV pour traiter la perte auditive héréditaire.
Fourni par l’Université Juntendo