Après des dommages aux vaisseaux sanguins, une coagulation sanguine efficace est essentielle pour arrêter les saignements. Cependant, ce processus est inefficace chez certaines personnes en raison de facteurs héréditaires. L’hémophilie B, par exemple, résulte d’une carence en facteur de coagulation IX (FIX), ce qui peut entraîner des saignements prolongés après des blessures ou une chirurgie.
Ainsi, les patients atteints d’hémophilie B sont souvent traités avec une correction recombinante comme une thérapie de remplacement, et bien que cette approche ait amélioré le traitement de l’hémophilie B, les demi-vies plasmatiques des produits approuvées ne sont que d’environ 3 à 4 jours et des injections fréquentes sont nécessaires. Par conséquent, il y a un besoin pressant de produits de correction recombinants avec une demi-vie plasma améliorée qui permet un dosage moins fréquent.
Dans une étude publiée dansCommunications de la natureles laboratoires du professeur Jan Terje Andersen à l’Université d’Oslo et Alessio Branchini / Mirko Pinotti à l’Université de Ferrara (Italie) présentent la conception et la caractérisation des variantes de correctifs à l’albumine humaine à longue durée, chacune présentant des propriétés pharmacocinétiques uniques.
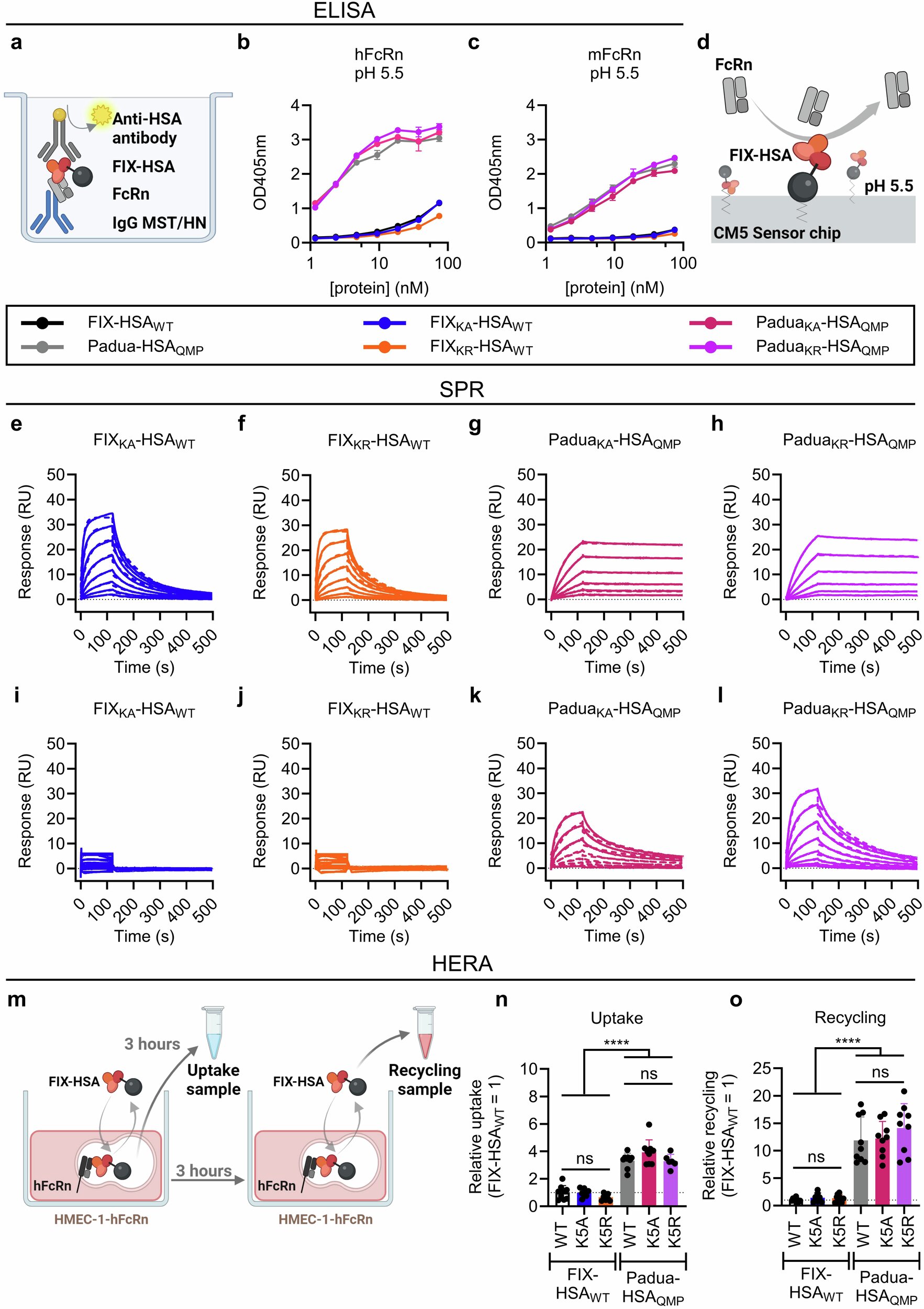
L’avancement a été rendu possible par l’utilisation d’une variante d’albumine humaine conçue avec trois substitutions d’acides aminés, E505Q / T527M / K573P (QMP), avec une liaison accrue du pH au récepteur FC néonatal (FCRN), un récepteur cellulaire critique pour l’homéostasie de l’albumine. Cette variante d’albumine a été fusionnée pour des variantes de fixation d’ingénierie, et les molécules résultantes ont été démontrées comme une demi-vie de plasma étendue mais distincte.
La substitution d’acides aminés Hyperactive FIX R338L (PADUA) a été incorporée parallèlement à une modification supplémentaire qui affecte l’interaction du correctif avec le réservoir de collagène IV extravasculaire. Plus précisément, une lysine (K5) a été remplacée par de l’alanine (K5A) ou de l’arginine (K5R). Cela module l’affinité de liaison entre FIX et Collagène IV, en ce que K5A réduit et K5R améliore l’interaction.
Notamment, la substitution de Padoue contrecarre l’activité réduite de la variante K5A, car une hyperactivité a été observée dans toutes les fusions de correctifs fusionnées d’albumine qui contiennent Fix Padoue. Surtout, les variantes de correctifs d’ingénierie ont été efficacement clivées de l’albumine lors de l’activation par FXIA, ce qui est nécessaire pour une activité coagulante optimale de FIX.
En outre, bien que l’efficacité du traitement de remplacement soit généralement évaluée sur la base de l’activité FIX dans le plasma, il est important de considérer que FIX se lie également au collagène extravasculaire IV, qui contribue à l’efficacité globale de la coagulation sanguine. Des études sur un modèle de souris d’hémophilie B ont montré que la substitution d’acides aminés FIX K5R améliorait la distribution extravasculaire de l’albumine Fonde par padoue QMP. La modification a en fait amélioré la distribution et la demi-vie fonctionnelle par triple.
Par conséquent, cette ingénierie a abouti à un candidat thérapeutique caractérisé par une amélioration de la biodistribution et un profil fonctionnel favorable. En revanche, la variante de correction de Padua avec la substitution des acides aminés K5A a démontré une distribution extravasculaire négligeable, tout en présentant les taux plasmatiques les plus élevés à des moments précoces suivis d’une baisse rapide.
Dans l’ensemble, ces résultats approuvent l’utilisation de la PADUA K5A et du PADUA K5R et Padua K5R (QMP) comme options hyperactives pour une thérapie à court ou à long terme, offrant des possibilités de thérapie de remplacement de l’hémophilie B personnalisée.
« Avant les progrès du traitement, les patients atteints d’hémophilie B – en particulier ceux qui ont des cas graves – ont fait l’objet d’une espérance de vie significativement réduite, succombant souvent à des complications telles que des saignements intracrâniens incontrôlés ou des hémorragies conjointes avant d’atteindre l’adulte. Cependant, les majeures cassures biotechnologiques au cours des décennies ont conduit à un développement amélioré des thérapies capables de la maladie.
« Malgré ces progrès, il reste une opportunité substantielle d’améliorer la conception des produits FIX, en particulier pour améliorer l’adhésion aux régimes prophylactiques qui nécessitent actuellement des perfusions fréquentes. Dans notre dernier article, nous discutons de la façon dont l’albumine humaine conçue, optimisée pour une amélioration de l’engagement du FCRN, peut servir de transporteur pour les variantes de fixation qui sont spécifiquement conçues pour cibler l’espace extraceux. Ces conceptions de protéines guidées par la biologie peuvent ouvrir la voie à des options de traitement plus personnalisées », explique le professeur Jan Terje Andersen.