Si le cancer est une maladie de surabondance, où les cellules se divisent sans restriction et où les tumeurs se développent malgré les meilleurs intérêts de l’organisme, alors les maladies dégénératives sont des troubles de privation. Lorsque des dysfonctionnements surviennent dans la machinerie biologique que nos muscles ou notre cerveau utilisent pour se renouveler et se réparer, ces tissus se flétrissent progressivement. Ce type de déclin est la marque de maladies comme la maladie d’Alzheimer ou la dystrophie musculaire de Duchenne.
Les scientifiques cherchent depuis longtemps à développer des traitements qui améliorent les capacités d’auto-renouvellement du muscle pour éviter la dégénérescence. L’utilisation de cette approche, connue sous le nom de médecine régénérative, pour traiter la dégénérescence des muscles squelettiques a présenté aux scientifiques des obstacles de taille.
Les chercheurs ont trouvé difficile de générer un approvisionnement adéquat en cellules thérapeutiques. Ces cellules ont également tendance à être immatures, ce qui limite leur potentiel de régénération.
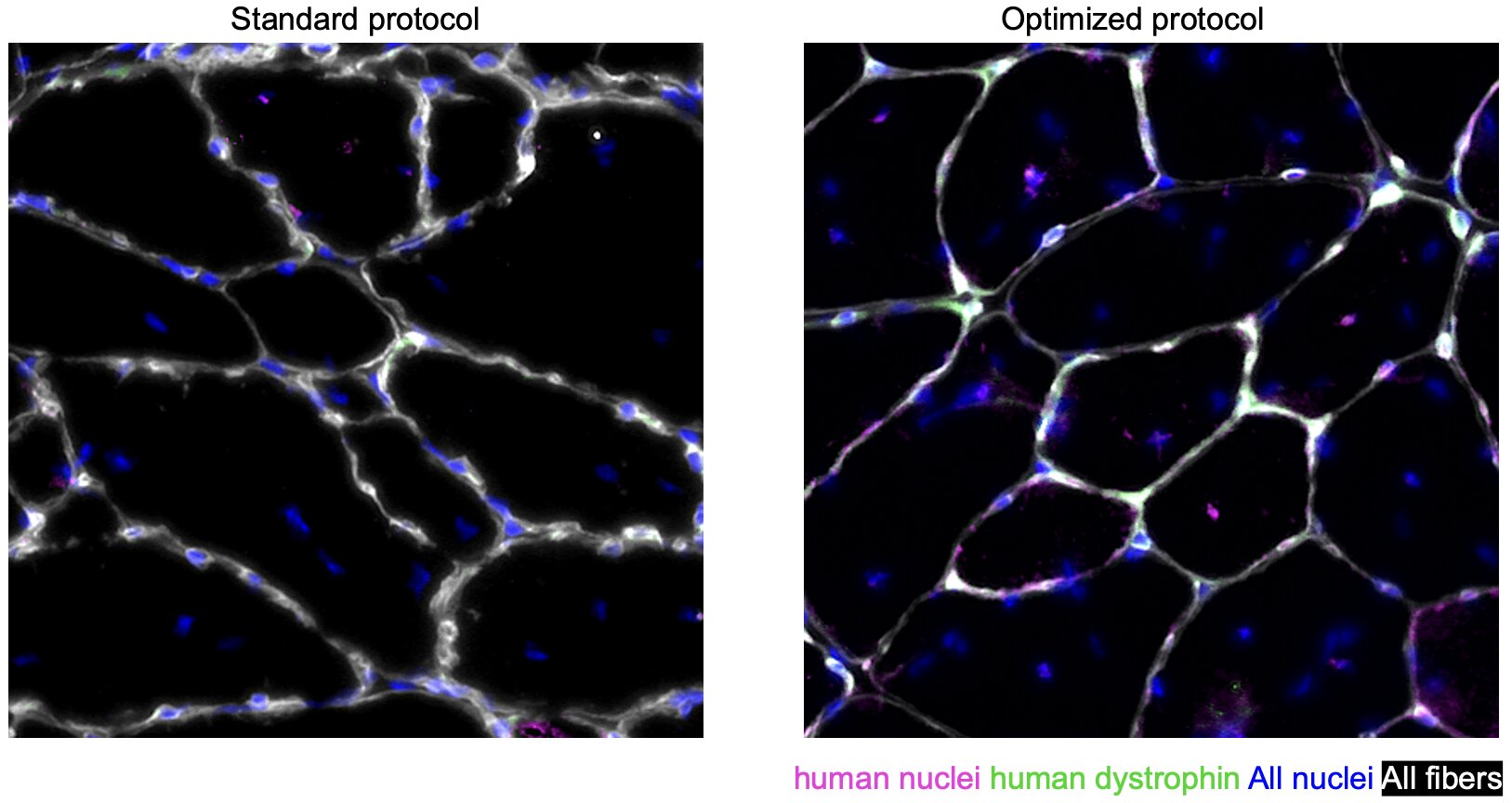
Des scientifiques du Sanford Burnham Prebys Medical Discovery Institute ont publié leurs résultats dans Rapports sur les cellules souches démontrant une nouvelle méthode qui produit jusqu’à deux fois plus de cellules thérapeutiques que les protocoles précédents, tout en fournissant également des cellules plus matures et plus efficaces.
Cela marque une étape importante dans l’avancement du traitement par médecine régénérative de la dystrophie musculaire de Duchenne et d’autres maladies musculaires dégénératives.
« Dans le cas de la dystrophie musculaire de Duchenne, vous avez un tissu malade parce qu’il lui manque une protéine fondamentale », a déclaré Alessandra Sacco, Ph.D., doyenne de l’École supérieure des sciences biomédicales de l’institut et professeur du Centre des maladies cardiovasculaires et musculaires.
« L’objectif global est de développer un traitement de médecine régénérative avec des cellules souches saines et entièrement fonctionnelles, afin de pouvoir remplacer les tissus malades par des tissus sains, corrigeant ainsi complètement la maladie. »
Les cellules sur lesquelles Sacco et son équipe se sont concentrées dans cette nouvelle étude sont appelées cellules progénitrices des muscles squelettiques. Ces cellules descendent de cellules souches et sont préparées à se développer en cellules musculaires plus matures et spécialisées pour réparer les tissus endommagés par une utilisation normale ou une blessure.
« La génération suffisante de ces cellules myogéniques constitue un goulot d’étranglement critique affectant diverses applications », a déclaré Luca Caputo, Ph.D., associé postdoctoral à Sanford Burnham Prebys et auteur principal et co-correspondant du manuscrit.
« Il s’agit notamment de la modélisation de maladies musculaires dans une boîte de Pétri, du dépistage de nouveaux médicaments potentiels et de thérapies régénératives cellulaires. »
Pour savoir comment éliminer ce goulot d’étranglement avec un plus grand rendement en cellules progénitrices, l’équipe de recherche a bloqué l’activité de la Janus kinase 2 (JAK2), une protéine de signalisation identifiée par les scientifiques lors d’études antérieures en raison de ses effets sur les cellules souches musculaires.
« Nous savons que JAK2 fait partie d’une voie classique dans laquelle ses signaux activent une autre protéine appelée transducteur de signal et activateur de transcription 3, ou STAT3 », a déclaré Sacco.
« Nous avions précédemment observé que le blocage temporaire de cette voie permettait aux cellules progénitrices musculaires de se développer chez la souris. Nous voulions donc tester cela sur des cellules humaines. »
Les scientifiques ont modulé JAK2 dans des cellules souches embryonnaires et induit des cellules souches pluripotentes fabriquées à partir d’échantillons fournis par des patients atteints de dystrophie musculaire de Duchenne.
« Nous avons constaté une multiplication par deux du rendement en cellules progénitrices musculaires », a déclaré Sacco. « Nous avons ensuite transplanté les cellules chez une souris et nous avons constaté qu’elles étaient fonctionnelles et contribuaient à la réparation des tissus. »
Ensuite, l’équipe de recherche a examiné le niveau de maturation des cellules résultantes.
« Habituellement, lorsque vous générez des cellules à partir de cellules souches pluripotentes induites ou de cellules souches embryonnaires humaines, ces cellules sont immatures ou embryonnaires », a déclaré Caputo. « Ce ne sont pas les mêmes cellules qu’un être humain développé aura dans son corps, et elles doivent mûrir afin d’être plus fonctionnelles pour une utilisation en médecine régénérative. »
En plus de générer environ deux fois plus de cellules progénitrices, les scientifiques ont découvert que l’inhibition de JAK2 faisait passer ces cellules du stade embryonnaire à un stade fœtal ou néonatal tardif.
« Nous avons montré chez la souris que ces cellules plus matures sont plus efficaces pour la régénération musculaire », a déclaré Sacco. « Avec une plus grande puissance, nous prévoyons que vous aurez besoin de moins de cellules pour traiter un seul patient.
« En combinant un rendement et une puissance accrus, davantage de patients pourraient être traités avec chaque préparation de ces cellules, ce qui sera important pour créer un jour un traitement accessible au plus grand nombre de patients et de familles possible. »
Des recherches supplémentaires sont nécessaires pour faire de la médecine régénérative une option sûre et efficace pour les patients atteints de dystrophie musculaire de Duchenne ou d’autres maladies dégénératives. Cela implique de comprendre comment administrer au mieux la thérapie cellulaire aux muscles des patients.
Un nouvel essai clinique issu des études du groupe du Dr Rita Perlingeiro à l’Université du Minnesota s’est ouvert en 2025 pour tester la sécurité et la tolérabilité des injections locales.
L’équipe de recherche de Sanford Burnham Prebys reconnaît la nécessité de continuer à améliorer le processus de génération de cellules progénitrices musculaires et à comprendre ce qui régit leur maturation.
« Nous allons affiner complètement les molécules que nous pouvons utiliser pour inhiber la signalisation JAK2 », a déclaré Caputo. « Cela devrait nous aider à générer davantage de cellules et de cellules plus proches d’un stade postnatal et périnatal. »
« Nous voyons également des opportunités du côté de la recherche fondamentale pour mieux comprendre les signaux moléculaires qui déterminent la maturation des cellules progénitrices », a déclaré Sacco.
« Cela améliorera la façon dont nous générons et testons ces cellules thérapeutiques, et nous permettra d’appliquer nos découvertes plus largement à d’autres maladies dégénératives. »