Le virus de la grippe A (IAV) a été à l’origine de six pandémies grippales majeures, responsables de 50 à 100 millions de décès dans le monde. Rien qu’aux États-Unis, on estime qu’en dépit des vaccins mis à jour selon les saisons, les infections par l’IAV entraînent toujours entre 140 000 et 710 000 hospitalisations et entre 12 000 et 52 000 décès par an.
Le développement de traitements antiviraux contre l’IAV – ou d’approches de vaccination plus durables d’ailleurs – a été extrêmement difficile car l’IAV développe facilement une résistance contre eux en modifiant sa constitution génétique. À ce jour, sa capacité à « muter », à réorganiser son information génétique ou même à la recombiner avec celle d’autres virus IAV infectant la même cellule a constitué un défi insurmontable pour les développeurs de médicaments et présente un risque constant d’émergence de nouvelles souches pandémiques.
La recherche d’une arme efficace contre la constitution génétique en constante évolution de l’IAV a été entravée par l’absence d’un modèle humain in vitro approprié pour tester de nouveaux traitements. Ce défi est aggravé par le fait que les modèles animaux d’infection par l’IAV ne parviennent pas à reproduire avec précision les réponses immunitaires humaines et que l’administration de médicaments dans les tissus pulmonaires humains s’effectue dans des conditions différentes de celles des animaux.
De nouvelles approches basées sur la technologie d’édition génétique CRISPR sont à l’étude, mais les séquences ciblées sont si spécifiques à l’homme que les études ne peuvent pas être menées de manière significative sur des modèles animaux.
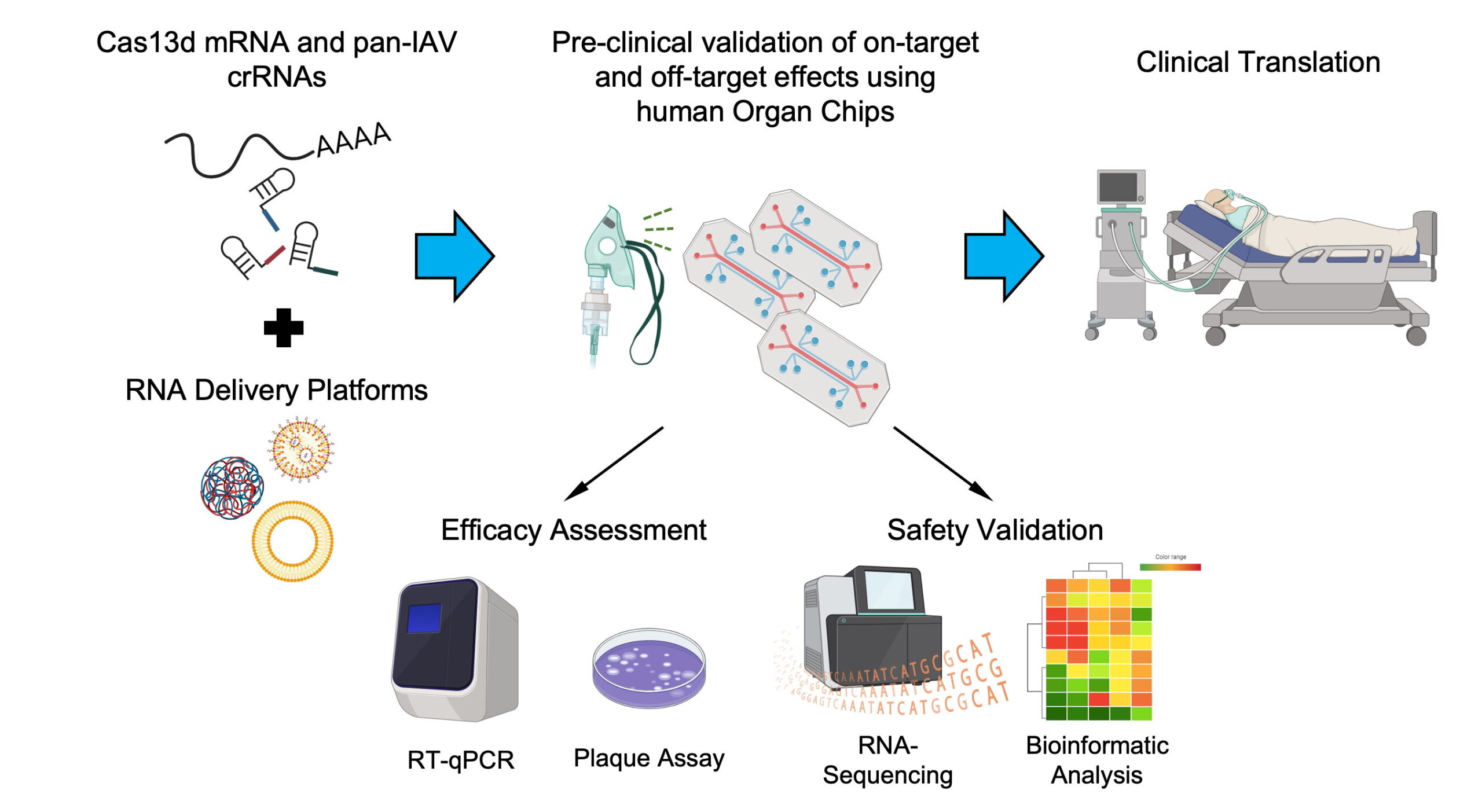
Maintenant, une nouvelle étude collaborative du Wyss Institute for Biologically Inspired Engineering de l’Université Harvard a relevé ces défis en exploitant simultanément un modèle microfluidique de puce d’alvéole pulmonaire humaine (puce pulmonaire) « respiratoire » d’infection par IAV développé dans le groupe du directeur fondateur Donald Ingber, MD, Ph.D. ; plates-formes d’administration de médicaments avancées par la directrice associée Natalie Artzi, Ph.D. et son groupe ; et la technologie CRISPR de pointe.
L’équipe y est parvenue en concevant un mécanisme CRISPR ciblant une séquence fortement conservée dans le génome de l’IAV, en l’emballant dans de minuscules nanoparticules ayant une affinité avec les cellules épithéliales pulmonaires et en délivrant les particules chargées aux cellules épithéliales pulmonaires tapissant un canal microfluidique dans la puce pulmonaire infectée par un IAV pandémique.
En conséquence, la charge virale dans les tissus modifiés a été réduite de plus de 50 % après une seule administration du traitement, et la réponse inflammatoire de l’hôte provoquée par le virus a été considérablement atténuée. Il est important de noter que seuls des effets minimes hors cible, révélés par l’analyse transcriptomique, se sont produits dans le système. Ainsi, ce modèle de puce d’organe qui imite mieux l’infection humaine par l’IAV que d’autres modèles précliniques permet d’évaluer l’efficacité et la sécurité des thérapies à ARN CRISPR d’une manière plus pertinente sur le plan clinique que les approches antérieures.
Les résultats sont publiés dans Laboratoire sur puce.
« Nos résultats démontrent que le modèle de puce pulmonaire humaine de l’infection par l’IAV est un banc d’essai préclinique très précieux pour les thérapies à base d’ARN CRISPR qui agissent largement sur les souches virales, car il rend non seulement compte de leur efficacité d’une manière pertinente pour l’homme, mais, surtout, permet également d’évaluer leurs effets potentiels hors cible, que nous trouvons jusqu’à présent minimes », a déclaré Ingber.
« Étant donné la forte probabilité de futures pandémies et la variation saisonnière naturelle de l’IAV, de tels traitements antiviraux pan-IAV pourraient nous aider à devancer le virus et, potentiellement, à sauver des milliers de vies. »
Ingber est également professeur Judah Folkman de biologie vasculaire à la Harvard Medical School et au Boston Children’s Hospital, et professeur Hansjörg Wyss d’ingénierie d’inspiration biologique à SEAS.
Parmi les autres auteurs de l’étude figuraient Ryan Posey, Haiquing Bai, Amanda Jiang, Pere Dosta, Diana Ocampo-Alvarado, Robert Plebani, Jie Ji et Chaitra Belgur.