Le rotavirus provoque de graves diarrhées déshydratantes chez les nourrissons et les jeunes enfants, contribuant à plus de 128 500 décès par an dans le monde malgré les efforts de vaccination généralisés. Bien que le rotavirus soit plus répandu dans les pays en développement, la baisse du taux de vaccination aux États-Unis a entraîné une augmentation des cas ces dernières années.
Une nouvelle recherche de la faculté de médecine de l’Université de Washington à Saint-Louis a identifié une étape clé qui permet au rotavirus d’infecter les cellules. Les chercheurs ont découvert que la désactivation du processus dans la culture tissulaire et chez la souris empêchait l’infection. Cette découverte ouvre de nouvelles voies d’intervention thérapeutique pour traiter le rotavirus et d’autres agents pathogènes qui reposent sur le même mécanisme d’infection.
Les résultats sont publiés dans PNAS.
« Le rotavirus tue les nourrissons et les enfants, les jeunes qui n’ont jamais eu la chance de vivre », a déclaré Siyuan Ding, Ph.D., professeur agrégé de microbiologie moléculaire à WashU Medicine. « C’est pourquoi nous voulons développer des traitements efficaces, même si nous disposons déjà de vaccins que nous pouvons utiliser. Tous les enfants ne reçoivent pas le vaccin et ce virus est très contagieux. Une fois qu’un enfant est infecté par le virus, il n’existe actuellement aucun traitement ; nous ne pouvons gérer que les symptômes. »
Enzyme comme code d’entrée
Pour identifier un traitement possible, Ding et ses collaborateurs se sont concentrés sur les caractéristiques des cellules du corps qui peuvent être exploitées pour se protéger contre les infections virales. Cette stratégie, a-t-il déclaré, est peut-être moins susceptible de déclencher une résistance aux médicaments que de cibler le virus lui-même et a le potentiel de fonctionner sur plusieurs maladies car elle est basée sur des voies d’infection partagées et non sur des caractéristiques spécifiques à la maladie.
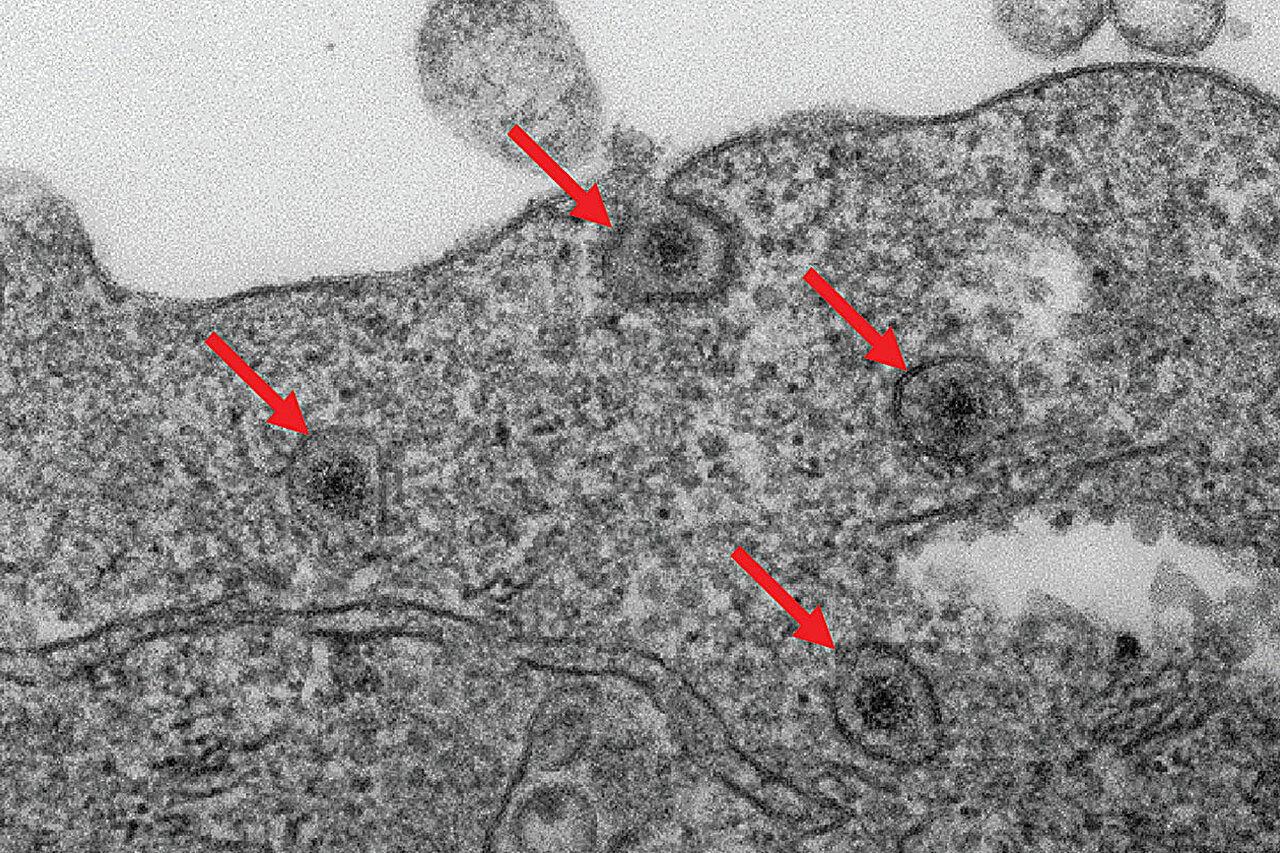
Lorsqu’une particule de rotavirus pénètre dans la paroi externe d’une cellule, elle n’est pas immédiatement libre d’infecter la cellule. Au lieu de cela, le virus émerge à l’intérieur d’un minuscule compartiment cellulaire appelé endosome.
Les chercheurs ont identifié une enzyme dans les cellules appelée acide gras 2-hydroxylase (FA2H), qui est essentielle pour briser les endosomes du rotavirus et infecter complètement les cellules. À l’aide de techniques avancées d’édition génétique, ils ont retiré le gène FA2H des cellules humaines et ont découvert que les virus restaient piégés dans les endosomes et ne pouvaient pas se répliquer efficacement. En d’autres termes, la désactivation de FA2H a empêché l’infection dès le début.
Pour confirmer ces résultats dans des modèles animaux, les chercheurs ont créé des souris génétiquement modifiées dépourvues spécifiquement de l’enzyme FA2H dans les cellules tapissant l’intestin grêle. Ces souris ont montré beaucoup moins de symptômes lorsqu’elles étaient infectées par le rotavirus par rapport aux souris normales, démontrant l’importance du FA2H dans les infections virales.
Contrairement aux vaccins qui incitent généralement l’organisme à produire des anticorps qui empêchent les agents pathogènes de pénétrer dans les cellules, la désactivation du FA2H intervient dans le cours normal de l’infection pour créer une ligne complémentaire de défense cellulaire basée sur l’hôte contre le rotavirus et les infections similaires.
« Les virus dépendent des hôtes, nous empêchons donc l’infection en les empêchant d’utiliser les machines de l’hôte », a déclaré Ding. « Nous ne savions pas vraiment comment cette enzyme, FA2H, fonctionnait avant cette étude, mais nous constatons maintenant que le même processus aide d’autres agents pathogènes, tels que le virus Junín et la toxine Shiga, ce qui suggère un « code d’entrée » commun utilisé par plusieurs agents pathogènes. «
Maintenant que Ding et ses collaborateurs ont identifié cette voie comme un mécanisme d’entrée largement exploitable, ils peuvent commencer à tester des médicaments qui reproduisent l’effet de l’édition du gène FA2H.