La fibrose des poumons est souvent une maladie silencieuse jusqu’à ce qu’elle soit trop tard. Au moment où les patients sont diagnostiqués, la cicatrisation de leur tissu pulmonaire est déjà avancée et les traitements actuels offrent un peu plus qu’un ralentissement de l’inévitable. Mais que se passe-t-il si nous pouvions comprendre les toutes premières étapes de cette maladie avant que des dommages irréversibles ne s’installent?
C’est la question que Claudia Loebel, Professeur adjoint de Reliance Industries en bio-ingénierie, et Donia Ahmed, un doctorant au laboratoire de Loebel, ont décidé de répondre. Leur Matériaux de la nature Paper, une étude collaborative couvrant l’Université de Pennsylvanie, l’Université du Michigan et l’Université Drexel, explore comment des changements subtils dans l’environnement mécanique du tissu pulmonaire pourraient déclencher la réaction en chaîne qui conduit à la fibrose.
Une nouvelle approche d’une maladie intraitable
La fibrose pulmonaire est notoirement difficile à diagnostiquer et à traiter.
« Une fois qu’il est diagnostiqué, les patients n’ont que deux médicaments approuvés par la FDA, et les deux ralentissent la maladie. Ils ne l’arrêtent pas ou ne l’arrêtent pas », explique Loebel. « Ce qui est pire, c’est que nous ne savons souvent pas ce qui l’a causé en premier lieu, donc nous n’avons pas non plus une idée claire de la façon de l’empêcher. »
Une grande partie de la recherche à ce jour s’est concentrée sur les derniers stades de la maladie, lorsque les tissus ont déjà raidi et marqué. Loebel et Ahmed ont décidé de retourner le script, examinant plutôt ce qui se passe bien au début. Plus précisément, ils ont examiné comment la rigidité tissulaire pourrait influencer le comportement cellulaire dans les poumons, offrant une nouvelle fenêtre sur la fibrose au fur et à mesure qu’elle se déroule.
Allumer le problème
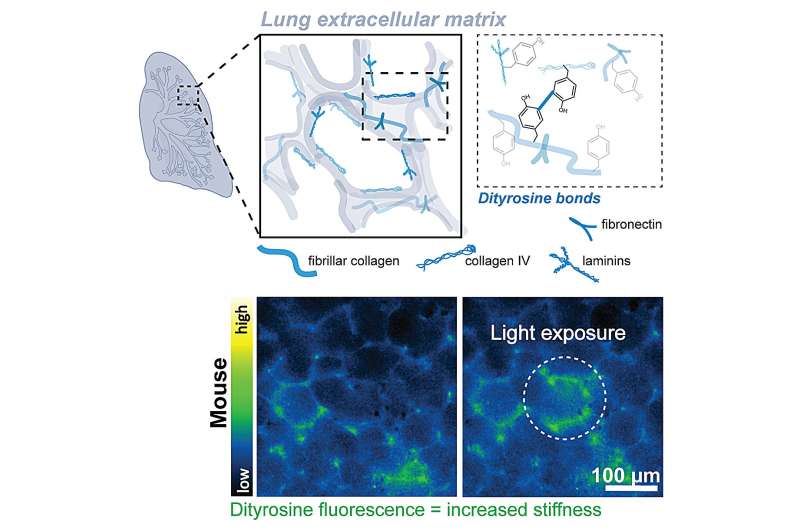
En utilisant une technique appelée réticulation photochimique, les chercheurs ont exposé le tissu pulmonaire à la lumière bleue, qui a déclenché la matrice extracellulaire – l’échafaudage fibreux entourant les cellules – pour se raidir. Contrairement à la lumière UV traditionnelle, la lumière bleue est plus douce sur les cellules vivantes, ce qui le rend idéal pour étudier les tissus vivants.
Avec ces éclairs de lumière bleue, l’équipe a pu localiser le raidissement des tissus chez la souris saine et le tissu pulmonaire humain.
« Pensez à la matrice extracellulaire comme les cheveux lâches en queue de cheval », explique Ahmed. « Avec une réticulation déclenchée par la lumière, nous la tressons, raidissant le tissu juste assez pour imiter le type de micro-blessures qui pourraient déclencher la fibrose. »
Ce qui rend cette approche unique, c’est que l’équipe n’a pas utilisé de gels techniques ou de tissu décellularisé. Au lieu de cela, ils ont travaillé avec des échantillons de tissus vivants intacts. Cette préservation des interactions cellulaires et matricielles naturelles fait de leur technique un outil puissant pour comprendre les réponses en temps réel aux changements mécaniques dans le poumon.
Les cellules qui ont du sens et restent coincées
Alors que les tissus se raidaient sous la lumière, Ahmed a observé que les cellules commençaient à s’étirer, changeant de forme. Et ce n’était pas seulement cosmétique. Cet étirement physique était un signe que les cellules passaient à un type de cellule différent.
Mais ensuite, ils ont calé.
« Ces cellules ont été prises dans une sorte de crise d’identité », explique Ahmed. « Ils étaient coincés entre les types, incapables de bien jouer le rôle. Et c’est un problème. »
Ces cellules « transitoires » ont déjà été repérées dans des échantillons de tissus fibrotiques, à la fois chez la souris et les humains. Ce qui n’a pas été compris, jusqu’à présent, c’est comment ils y arrivent.
Le modèle de Loebel et Ahmed suggère que les changements dans la rigidité des tissus seuls peuvent inciter les cellules à commencer la transition, et lorsqu’elles sont coincées, elles contribuent à la raideur même qui les a déclenchés – établissant une boucle de rétroaction potentielle qui accélère la maladie.
Imaginez le tunnel de jeu d’un enfant: quand il est doux et flexible, il est facile de ramper. Mais une fois qu’il devient rigide, le mouvement et la communication entre les individus deviennent difficiles. De même, dans une matrice extracellulaire raidi, les cellules peuvent être piégées, perdre leur fonction et changer de forme. Pire, ils peuvent attirer d’autres « mauvaises » cellules qui prospèrent dans des environnements rigides, aggravant les dommages.

Un problème mécanique avec les conséquences biologiques
Bien que la biologie de la fibrose ait été étudiée depuis longtemps, ce projet recadre la maladie comme un problème de mécanique.
« J’adore y penser du point de vue du génie mécanique », explique Ahmed. « Il ne s’agit pas seulement des signaux chimiques. L’environnement physique est profondément important. »
Pour mesurer à quel point le tissu était raide, l’équipe a utilisé un nanoindenter, un outil d’ingénierie généralement réservé aux matériaux de test comme les plastiques ou les métaux. Ils l’ont appliqué au tissu biologique, fournissant des données précises sur la façon dont la rigidité change en temps réel.
« Nous sommes particulièrement positionnés pour résoudre ce problème en raison de notre expertise en ingénierie et en biologie », explique Matthew Lee Tan, co-premier auteur et ancien boursier postdoctoral à l’Université du Michigan. « Cela nous permet d’identifier les opportunités d’appliquer des outils d’ingénierie pour étudier les maladies et découvrir de nouvelles informations biologiques. »
Cette approche interdisciplinaire, combinant des outils de l’ingénierie, des informations de la biologie et des modèles construites sur le vrai tissu humain, reflète l’esprit collaboratif de l’écosystème scientifique de Penn Engineering.
Où d’ici?
L’hypothèse principale de l’équipe est que ces cellules précoces, une fois coincés dans un état de transition, jettent les bases de la fibrose à progresser. Non seulement ils perdent leur fonction d’origine mais raidissent activement le tissu qui les entoure, ce qui rend l’environnement plus attrayant pour les cellules favorisant la fibrose.
Et tandis que cette étude s’est concentrée sur les cellules épithéliales – celles à l’interface entre le tissu pulmonaire et l’air – les chercheurs prévoient d’étendre leur travail à d’autres acteurs clés dans la fibrose: les macrophages, les fibroblastes et les neutrophiles.
« Ce n’est que la première étape », explique Loebel. « Maintenant que nous avons construit cet outil, nous pouvons l’utiliser pour examiner les contributions spécifiques aux cellules à la fibrose, non seulement dans les poumons, mais potentiellement dans d’autres organes comme le foie ou la peau, où la fibrose provoque également des problèmes de santé majeurs. »
Un plan pour les thérapies futures
En fin de compte, l’espoir est qu’en comprenant comment la raideur affecte les cellules dans les premières phases de la fibrose, les scientifiques et les médecins peuvent mieux prédire qui est en danger et quand intervenir.
« Nous n’essayons pas de recréer la fibrose en laboratoire », explique Loebel. « Nous identifions son point de départ. Si nous pouvons comprendre les premiers intervenants, nous pouvons travailler vers des traitements qui empêchent toute la cascade de se produire. »

