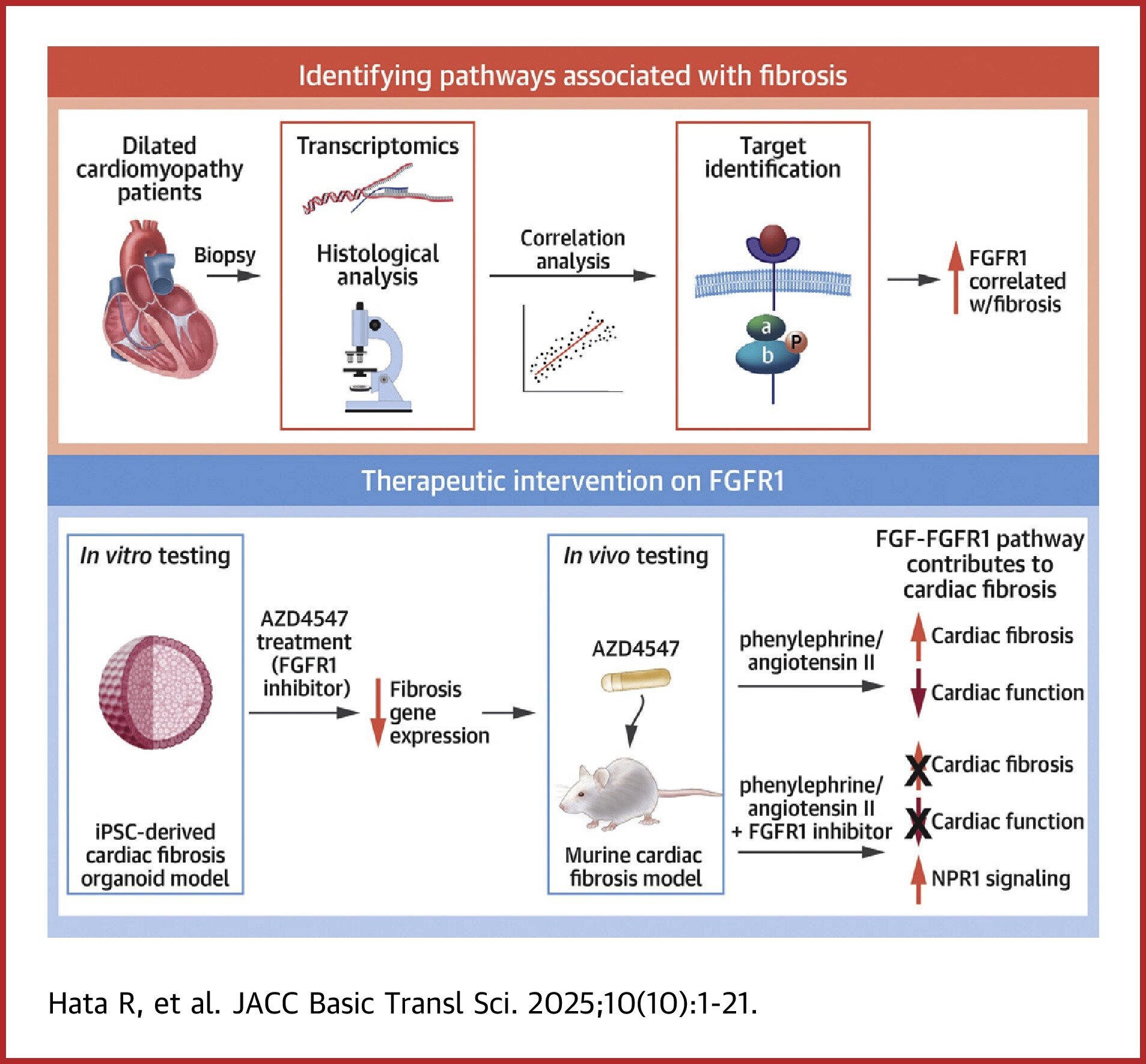
Grâce à une approche complète combinant le profilage transcriptomique, l’analyse histologique et la validation fonctionnelle dans les modèles organoïdes et animaux, une équipe de recherche dirigée par le professeur agrégé Yoshinori Yoshida et le professeur adjoint Shunsuke Funakoshi ont identifié le récepteur de la croissance des fibroblastes (FGFR1) comme une cible thérapeutique clé pour la fibrose cardiaque en cardiomyopathie dilective (DCM).
Le DCM est une cause majeure d’insuffisance cardiaque, caractérisée par une dilatation ventriculaire et une altération de la contractilité. La fibrose cardiaque exacerbe la progression de la maladie en remplaçant le myocarde fonctionnel par un tissu rigide et non contractile, mais les thérapies ciblées restent rares. Pour y remédier, les chercheurs ont analysé les biopsies myocardiques de 58 patients DCM en intégrant les données de séquençage de l’ARN aux analyses histologiques assistées par l’IA. Grâce à cette approche, ils ont identifié plusieurs gènes, dont MMP2, FGFR1, HRH2 et VIM, qui étaient fortement en corrélation avec la gravité de la fibrose.
Pour identifier les cibles thérapeutiques de ces gènes, ils ont utilisé un modèle de fibrose cardiaque cardiaque dérivé des cellules IPS humain. Grâce à cette approche, ils ont constaté que l’administration d’AZD4547, un inhibiteur sélectif de FGFR1, a considérablement supprimé la fibrose cardiaque. Ils ont en outre testé l’effet de l’AZD4547 dans un modèle murin de lésion cardiaque.
Remarquablement, le traitement a supprimé l’expression des gènes liés à la fibrose et a réduit le dépôt de matrice extracellulaire dans les modèles de fibrose in vitro et in vivo. Chez les souris, l’AZD4547 a amélioré la fonction cardiaque et inversé l’activation des fibroblastes induite par l’angiotensine II et la phényléphrine, suggérant son potentiel en tant qu’agent thérapeutique pour les maladies cardiaques fibrotiques.
Le séquençage d’ARN unique a en outre révélé que l’inhibition du FGFR1 réduisait la signalisation FGF pro-fibrotique entre les cardiomyocytes et les fibroblastes, tout en améliorant la signalisation NPR1 – une voie associée à la cardioprotection. Plus précisément, AZD4547 a augmenté l’expression du NPPA et du NPPB dans les cardiomyocytes, indiquant un double effet anti-fibrotique et cardioprotecteur.
De plus, ces changements moléculaires se sont accompagnés d’un décalage des populations de fibroblastes vers un phénotype plus reposant et une augmentation des cardiomyocytes métaboliquement optimisés, soutenant les avantages fonctionnels observés. Notamment, l’étude a également démontré que l’activation du FGFR1 est localisée principalement aux cellules stromales plutôt qu’aux cardiomyocytes, renforçant son rôle dans la conduite du remodelage fibrotique.
Contrairement aux études précédentes qui reposaient uniquement sur le profilage transcriptomique, ce travail intègre l’analyse histologique automatisée et la validation fonctionnelle, offrant une vision plus complète des mécanismes de fibrose et des réponses thérapeutiques. Compte tenu du rôle de FGFR1 dans le remodelage fibrotique, son inhibition peut détenir un potentiel thérapeutique non seulement pour le DCM mais aussi pour d’autres formes d’insuffisance cardiaque caractérisées par une fibrose excessive.
La méthodologie intégrative utilisée dans cette étude – la combinaison des données de biopsie clinique, l’analyse transcriptomique, la quantification histologique et les modèles avancés in vitro et in vivo – ont permis l’identification et la validation de FGFR1 en tant que cible thérapeutique prometteuse. Cette approche à plusieurs échelles renforce non seulement la pertinence biologique des résultats, mais fournit également un cadre de translation pour le développement futur des médicaments.
De plus, les résultats positionnent l’inhibition du FGFR1 comme une stratégie convaincante pour traiter la fibrose cardiaque et améliorer les résultats dans le DCM. La traduction clinique future peut impliquer la stratification des patients sur la base de l’activité FGFR1 ou la combinaison d’inhibiteurs de FGFR1 avec des thérapies sur l’insuffisance cardiaque existantes pour améliorer l’efficacité.
L’œuvre est publiée dans la revue JACC: Science de base à la translation.