Selon une nouvelle étude publiée dans une nouvelle étude publiée Communications de la nature.
Le cytomégalovirus humain (HCMV) est un virus commun qui infecte les personnes de tous âges. Aux États-Unis, près de 1 enfant sur 3 est déjà infecté par le CMV à l’âge de 5 ans et plus de la moitié des adultes ont été infectés par le HCMV à l’âge de 40 ans, selon les estimations des Centers for Disease Control and Prevention. Alors que la plupart des personnes atteintes de HCMV ne présentent aucun symptôme, le virus peut déclencher des problèmes de cerveau, de foie, de rate, de poumons et de croissance.
« Le cytomégalovirus humain est un virus répandu associé aux malformations congénitales congénitales et à plusieurs autres conditions graves », a déclaré l’auteur principal de l’étude Derek Walsh, Ph.D., professeur de microbiologie-immunologie. « Il a également un cycle de réplication très inhabituel qui s’étend sur 5 à 10 jours, au cours de laquelle il remodèle largement la cellule. »
Pour mieux comprendre comment le virus remodèle les cellules infectées, Walsh et ses collaborateurs ont utilisé des outils génomiques de pointe pour cartographier comment le HCMV manipule l’organisation tridimensionnelle des chromosomes. Grâce à la capture de conformation de la chromatine (Hi-C) et à la transcriptomique naissante, ils ont découvert que le virus provoque une désorganisation généralisée des interactions de la chromatine et de la formation de compartiments, tout en induit une expression gène anormale.
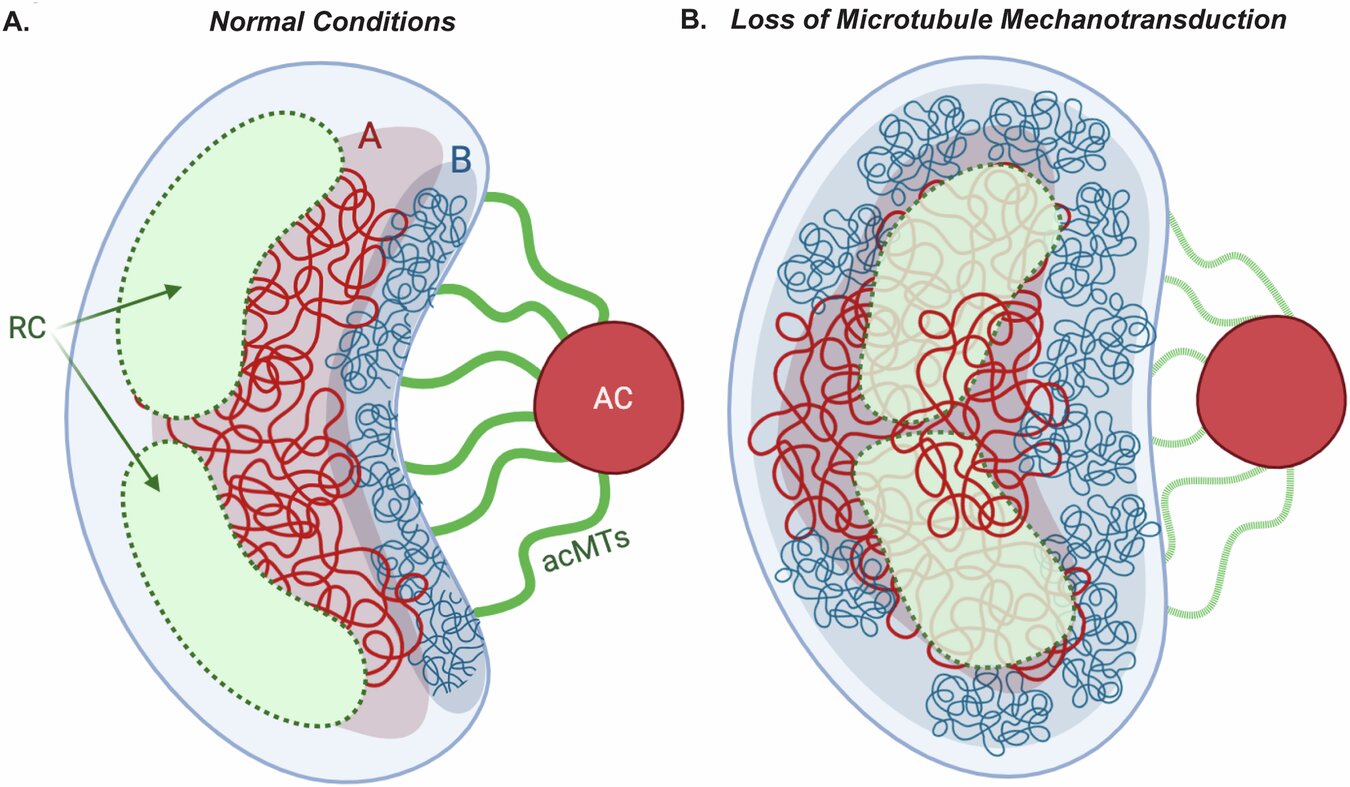
Ce remodelage comprend la création d’un nouveau centre organisant des microtubules qui fait pivoter le noyau, selon l’étude.
« Dans des recherches antérieures, nous avons constaté que le virus le fait pour séparer spatialement la chromatine de l’hôte des centres de réplication de l’ADN viral », a déclaré Walsh. « Mais nous ne savions toujours pas ce qui se passait à un niveau génétique. »
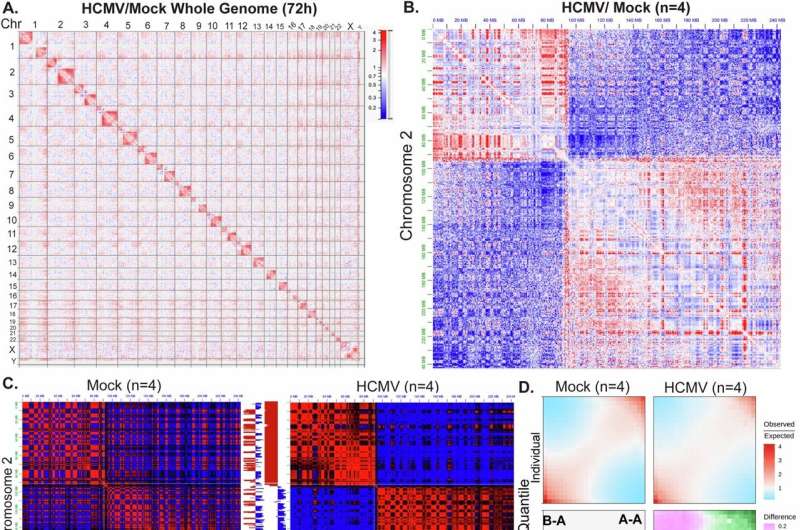
Ensuite, les scientifiques ont analysé le comportement du virus dans les cellules humaines cultivées après l’infection. Dirigée par Celeste Rosencrance, un étudiant du programme d’études supérieures de Driskill dans la vie (DGP) qui a été le premier auteur de l’étude, l’analyse a révélé que le virus préfère se reproduire dans les régions euchromatiques – des axes du génome qui sont moins des et plus actifs transcriptionnellement.
« Les forces de tir des microtubules aident à déplacer la chromatine plus dense à l’écart pour optimiser comment le virus crée des espaces de réplication nucléaire », a déclaré Walsh.
Bien que ces forces mécaniques ne semblent pas influencer la perturbation plus large de la chromatine ou du contrôle transcriptionnel, elles régulent les interactions à plus petite échelle, en particulier la façon dont l’ADN viral interagit avec la chromatine hôte.
Les nouvelles idées approfondissent non seulement la compréhension scientifique de l’impact du HCMV sur l’architecture cellulaire et l’expression des gènes, mais ouvrent également de nouvelles avenues pour les stratégies antivirales ciblant la capacité du virus à recâbler physiquement et génétiquement les cellules hôtes.
« Les gens ne considèrent souvent pas que le noyau est comme une enclume », a déclaré Walsh. « En tant que plus grand organite de la cellule, c’est un obstacle majeur à la migration cellulaire. Nous apprenons que le virus manipule exquis ces processus. »
Pour l’avenir, le laboratoire de Walsh explorera comment la mécanique des microtubules contribuera au mouvement nucléaire au cours des stades ultérieurs de l’infection à mesure que les cellules commencent à migrer.