La présentation de l’antigène compromis se classe parmi les principaux mécanismes qui rendent les cancers non immunogènes (non réactifs aux thérapies à base immunitaire). Malgré le port de la charge mutationnelle tumorale la plus élevée de tous les cancers, les carcinomes basoceliques (BCC) ont une faible immunogénicité.
La perte des composants des antigènes de leucocytes humains de classe I (HLA-I) est particulièrement répandu dans les cancers immunitaires.
Les antigènes tumoraux sont capturés et affichés par le traitement des antigènes et les machines de présentation (APM) sur la surface des cellules par HLA-I, ce qui le permet de CD8+ Les cellules T pour éliminer les cellules cancéreuses. Cependant, les cellules cancéreuses ont développé divers moyens pour limiter l’APM et échapper à la reconnaissance immunitaire.
Shawn Demehri, MD, Ph.D., médecin-investigateur au Cutaneous Biology Research Center et Krantz Family Center for Cancer Research au Massachusetts General Hospital et professeur agrégé de dermatologie à la Harvard Medical School, est l’auteur principal d’une étude en Rapports cellulairesintitulé « La régulation épigénomique de la tige contribue à la faible immunogénicité du cancer humain le plus muté. »
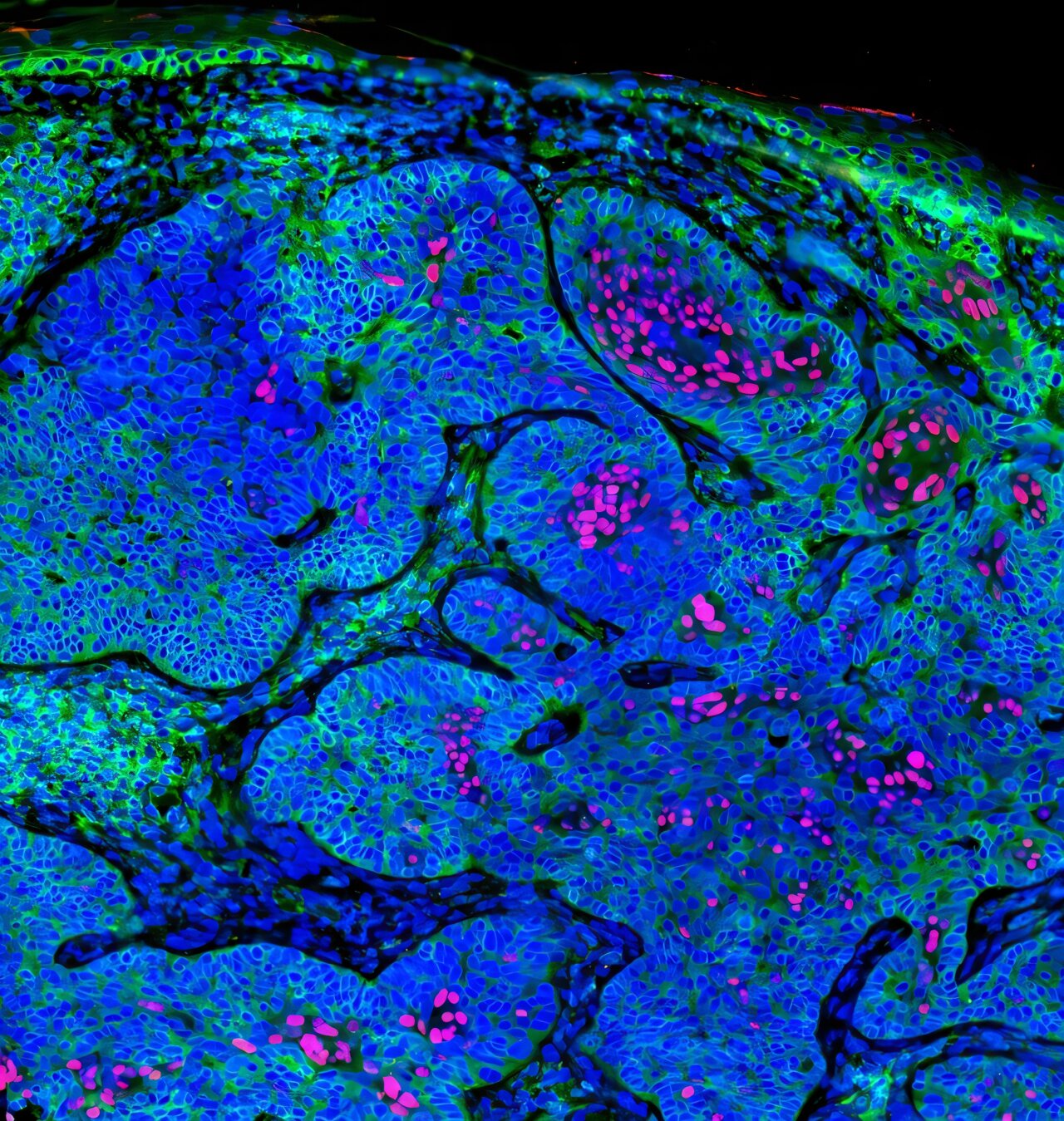
Pour déterminer l’état immunitaire de BCC, l’équipe de recherche de Demehri a étudié une grande collection de BCC humains primaires par rapport aux carcinomes épidermoïdes (SCC), qui se sont révélés plus sensibles aux thérapies à base immunitaire. Ils ont découvert que les BCC primaires avaient un phénotype immunitaire-exclu associé à une expression minimale de HLA-I par les cellules cancéreuses, même pendant leur développement précoce.
Les chercheurs ont également déterminé qu’un programme de repos de type STEM qui a persisté à partir de la cellule d’origine de la tumeur a supprimé les gènes APM dans les cellules BCC, et que l’inversion épigénomique de la suppression du gène APM a permis l’immunothérapie BCC.
Ces résultats révèlent la cellule d’origine comme le déterminant dominant de l’immunogénicité du cancer dans les BCC et indiquent une nouvelle approche qui pourrait améliorer le traitement.
Le carcinome kératinocytaire, y compris les BCC et les SCC cutanés, est le cancer le plus courant avec une augmentation continue de l’incidence.
Les SCC présentent un taux de réponse objectif de 49,3% à la thérapie PD-1, tandis que le BCC métastatique n’a que 21% de thérapie anti-PD-1.
Les transplantés d’organes sur les immunosuppresseurs systémiques présentent un risque de SCC plus élevé à plus de 100 fois plus élevé par rapport à la population générale, mais seulement un risque de BCC de six à 16 fois plus élevé, ce qui suggère que le BCC peut manquer d’immunogénicité.
Demehri explique: « Pour déterminer l’état immunitaire de BCC, nous avons étudié une grande collection de BCC humains primaires par rapport aux SCC. Bien que les cellules T aient été détectables dans le stroma entourant le BCC, significativement moins CD4 CD4+ et CD8+ Les cellules T infiltrées dans les foyers de tumeurs BCC par rapport aux SCC. Une étude des autres cellules immunitaires a révélé qu’elles étaient également significativement réduites dans le BCC par rapport au SCC.
« Le séquençage d’ARN unique sur des échantillons BCC et SCC recueillis avec des méthodes de préparation de cellules similaires a montré des populations de cellules immunitaires beaucoup plus petites dans le BCC par rapport au SCC.
« Surtout, les premiers BCC avec des cellules T rares dans le stroma ont montré une faible expression HLA-I, indiquant que de faibles niveaux d’APM dans le BCC proviennent d’un mécanisme intrinsèque intégral à sa biologie du développement.
« Nous avons également constaté que FOXC1 est un suppresseur critique de IRF1 et HLA-I dans les cellules BCC, rappelant sa fonction dans les cellules souches du follicule pileux quiescente. FOXC1 régule à la baisse IRF1 et HLA-I par des mécanismes épigénomiques, qui peuvent être réversés pour permettre l’immunothérapie BCC. »
Implications cliniques
« Nous démontrons que le traitement topique de l’entinostat régule à la hausse la présentation de l’antigène dans le BCC in vivo », poursuit Demehri. «En tant que tel, la combinaison de l’entinostat avec l’immunothérapie topique et systémique est la clé pour permettre l’immunothérapie BCC.
« Pour y parvenir, nous avons combiné l’entinostat topique avec une immunothérapie topique approuvée par la FDA, l’imiquimod. La haute efficacité de l’imiquimod entinostat plus dans la suppression du développement du BCC indique que l’imiquimod induit par l’entinostat dans le BCC dans le BCC.
« Sur la base de nos résultats, un premier essai clinique humain est justifié pour étudier l’efficacité de cette thérapie combinée pour le traitement du BCC chez l’homme. »