Le professeur Kenji Osafune (Département de croissance et de différenciation cellulaire) et son équipe de chercheurs ont conçu un moyen efficace de cultiver des cellules progénitrices rénales dérivées de cellules IPS, ouvrant la voie à la réalité des thérapies régénératives rénales. Les résultats sont publiés dans la revue Médecine translationnelle scientifique.
La médecine moderne continue d’être entravée par le manque de traitements efficaces pour les lésions rénales aiguës (AKI) et la maladie rénale chronique (CKD). La médecine régénérative, comme les thérapies de remplacement cellulaire, représente un nouvel espoir pour les patients. Pourtant, de telles approches thérapeutiques nécessitent une production à grande échelle des cellules nécessaires, qui était restée un défi jusqu’à cette découverte.
En utilisant un modèle de souris d’AKI, l’équipe de recherche a d’abord démontré le potentiel thérapeutique des cellules progénitrices néphron dérivées de cellules IPS humaines (HIPSC-NPC). Lorsque ces cellules ont été transplantées dans les reins des modèles de souris AKI induits par un médicament anti-cancéreux, le cisplatine, la survie des animaux a été largement améliorée en empêchant la détérioration de la fonction rénale.
Cependant, compte tenu de la différence de taille corporelle entre les souris et les humains, un grand nombre de cellules seraient nécessaires si la transplantation HIPSC-NPC consiste à devenir une thérapie régénérative réaliste pour un usage médical chez les patients humains. En tant que tels, les chercheurs sont retournés à la planche à dessin et ont considéré de nouvelles façons d’étendre ces cellules en culture.
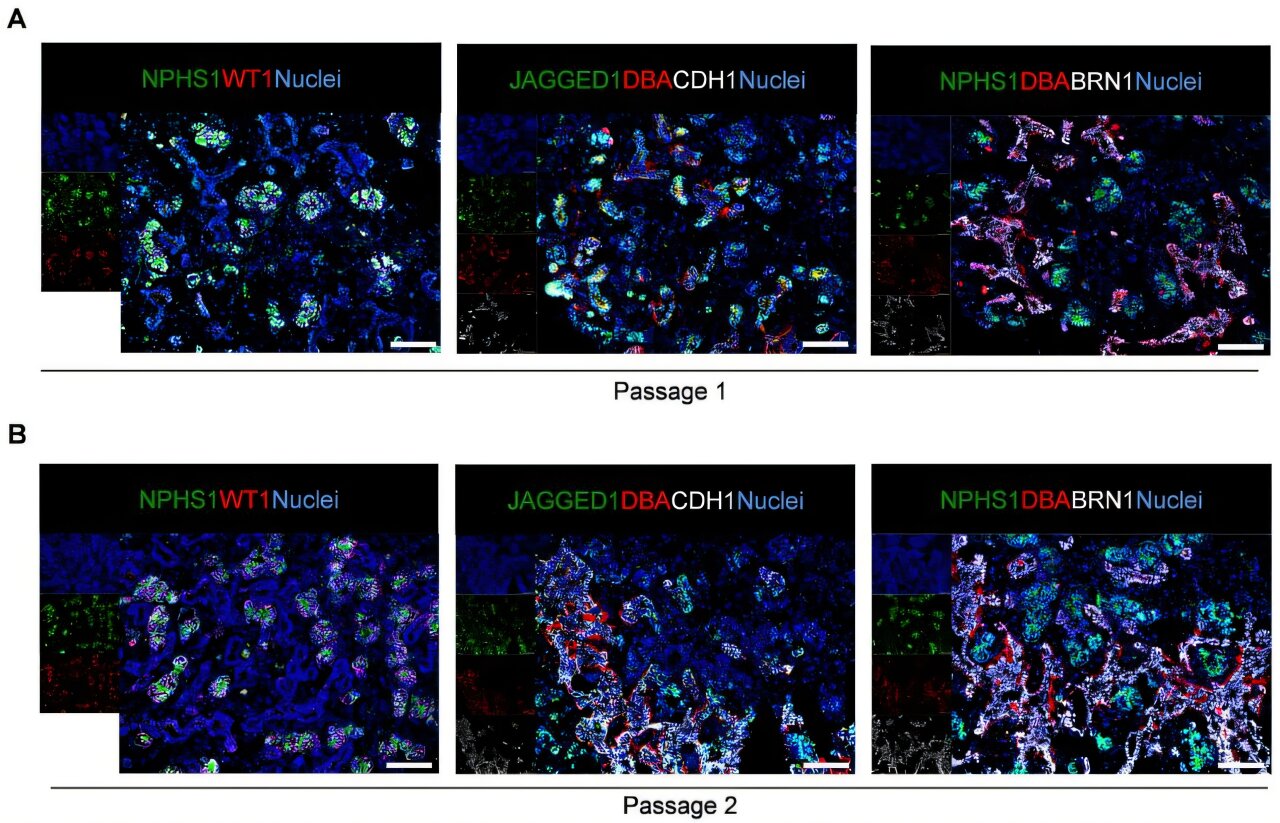
Au lieu de cultiver les cellules dans une seule couche dans un milieu traditionnel, en les cultivant sous forme de touffes de cellules en suspension dans un milieu qui comprend trois produits chimiques connus pour influencer la croissance et le développement des reins, les chercheurs ont trouvé les cellules qu’ils continuent d’exprimer des marqueurs de protéines caractéristiques des PNJ et de conserver leur capacité à une expansion continue. Après la transplantation dans les reins de souris, ils se sont différenciés en différents types de cellules rénales, formant diverses parties de l’organe.
Les chercheurs ont remarqué que la croissance de ces touffes cellulaires dépend fortement de la densité des cellules de départ, ce qui suggère que l’approvisionnement en oxygène peut être un facteur limitant. De manière critique, ils ont trouvé des cellules étendues de cette manière pour posséder un potentiel thérapeutique similaire lorsqu’ils sont transplantés en modèles de souris d’AKI ou de CKD, indiquant qu’ils ont trouvé un moyen d’élargir considérablement les cellules nécessaires aux thérapies cellulaires tout en conservant leur capacité à fonctionner efficacement une fois transplanté.
De plus, grâce à une analyse détaillée de l’expression des gènes, l’équipe de recherche a identifié un nouveau marqueur qui pourrait s’avérer utile pour purifier les HIPSC-NPC. Pour démontrer l’utilité de ce marqueur nouvellement identifié, ils ont constaté qu’ils pouvaient étendre les HIPSC-NPC purifiés en utilisant ce marqueur par 100 fois simplement sur deux passages.
De plus, ils ont également découvert que les HIPSC-NPC produisaient du VEGF-A – une protéine sécrétée capable d’induire la formation et le maintien des vaisseaux sanguins – et ont démontré que les cellules dépourvues du gène Vegfa avaient une réduction du potentiel thérapeutique lorsqu’il était transplanté en modèles de souris.
Grâce à cette étude, les chercheurs, dirigés par le professeur Kenji Osafune, ont développé une méthode indispensable pour étendre les HIPSC-NPC afin qu’ils puissent être massivement produits en dehors du corps à l’avenir à des fins de médecine régénérative. En identifiant un nouveau marqueur pour leur purification et en élucidant le principal mécanisme sous-jacent à leurs effets thérapeutiques, le travail de l’équipe de recherche permet l’application réelle des HIPSC-NPC comme traitement potentiel pour AKI et CKD.