Chez les patients atteints de COVID long, une nouvelle étude a révélé une association structurelle entre les microcaillots circulants et les pièges extracellulaires à neutrophiles (TNE).
Cette découverte suggère l’existence d’interactions physiologiques sous-jacentes entre les microcaillots et les NETS qui, lorsqu’elles sont dérégulées, peuvent devenir pathogènes. L’ouvrage est publié dans le Journal de virologie médicale.
Que sont les microcaillots ?
Le terme microcaillots, récemment adopté dans la littérature scientifique, désigne des amas anormaux de protéines de la coagulation sanguine circulant dans la circulation sanguine d’un patient. Le concept a été introduit en 2021 par le professeur Resia Pretorius du département des sciences physiologiques de l’université de Stellenbosch, lorsqu’ils ont découvert la présence anormale de tels microcaillots dans les échantillons de sang de patients atteints de COVID-19. Cette découverte a suscité une large attention pendant la pandémie en raison de son rôle potentiel dans les coagulopathies liées au COVID.
Que sont les pièges extracellulaires à neutrophiles (TNE) ?
L’équipe du Dr Alain Thierry de l’Institut du Cancer de Montpellier (IRCM) de l’INSERM à Montpellier, a été parmi les premières à identifier le rôle critique des TNE dans la pathogenèse du COVID-19. Les NET sont produites par une forme spécialisée de réponse immunitaire innée connue sous le nom de NETosis, dans laquelle les neutrophiles expulsent leur ADN pour former des structures filamenteuses intégrées à des enzymes cytotoxiques capables de piéger et de neutraliser rapidement les agents pathogènes.
Cependant, la formation excessive de TNE peut devenir néfaste, contribuant à un large éventail de maladies inflammatoires et thrombotiques, notamment des infections graves, des maladies auto-immunes, le cancer, le diabète et l’arthrite.
Selon le Dr Thierry, il se pourrait que la surproduction persistante de TNE, alimentée par des boucles inflammatoires et thrombotiques auto-entretenues, exacerbe la gravité de la maladie.
Dans le cadre d’un effort collaboratif, les équipes du Pr Pretorius et du Dr Thierry ont étudié l’interaction potentielle entre les microcaillots et les TNE dans le contexte d’un long COVID.
Principales conclusions
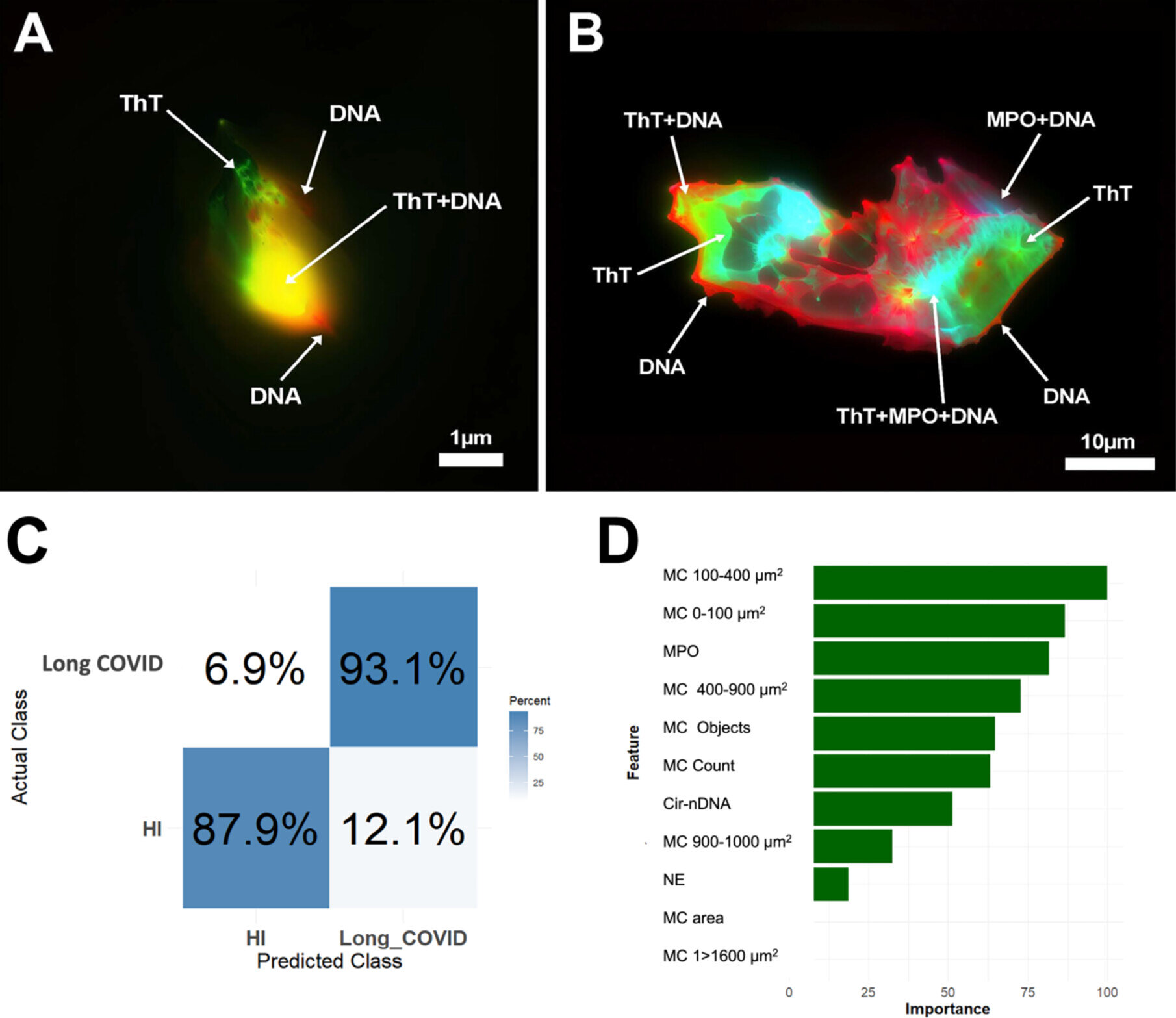
En utilisant la cytométrie en flux d’imagerie et la microscopie à fluorescence, ils ont effectué une analyse quantitative et structurelle des microcaillots et des TNE dans le plasma de patients atteints de COVID long, par rapport à des témoins sains. Les NET ont également été quantifiés en analysant les marqueurs protéiques des NET et l’ADN en circulation.
- Ils ont observé une augmentation significative des biomarqueurs associés aux microcaillots et aux TNE dans les échantillons de patients.
- Les microcaillots étaient non seulement plus abondants, mais également plus gros chez les patients.
- Plus important encore, ils ont découvert une association structurelle non signalée auparavant entre les microcaillots et les TNE, observée chez tous les sujets mais nettement plus prononcée chez les patients atteints de COVID longue.
« Cette découverte suggère l’existence d’interactions physiologiques sous-jacentes entre les microcaillots et les TNE qui, lorsqu’elles sont dérégulées, peuvent devenir pathogènes », explique le Dr Thierry.
De plus, l’intégration d’outils d’intelligence artificielle, tels que l’apprentissage automatique, dans l’analyse des biomarqueurs leur a permis de distinguer avec une grande précision les patients atteints d’une longue COVID des individus en bonne santé. Les algorithmes ont identifié les combinaisons de biomarqueurs les plus prédictives, améliorant ainsi la fiabilité du diagnostic et ouvrant la voie à des approches de médecine personnalisée.
Selon le professeur Pretorius, les résultats révèlent une accumulation significative de microcaillots dans le plasma des patients atteints de COVID longue, probablement entraînée et stabilisée par une production excessive de TNE : « Cette interaction pourrait rendre les microcaillots plus résistants à la fibrinolyse, favorisant leur persistance dans la circulation et contribuant aux complications microvasculaires chroniques », explique-t-elle.
En identifiant le rôle mécaniste des TNE dans la stabilisation des microcaillots, cette étude fournit de nouvelles informations sur la physiopathologie du COVID long. Ces résultats soutiennent le développement de stratégies thérapeutiques ciblées visant à moduler les réponses thrombo-inflammatoires.
Enfin, l’étude ouvre la voie au développement de nouveaux biomarqueurs pour le diagnostic et la gestion : « La combinaison de techniques d’imagerie avancées et d’apprentissage automatique confère une robustesse méthodologique et contribue de manière significative au discours scientifique en cours sur les syndromes post-viraux », concluent-ils.