Les glycanes sont d’importants glucides complexes présents à la surface des cellules et qui jouent un rôle crucial dans la communication, la structure et la protection de cellule à cellule. Ils sont attachés à de nombreuses protéines du corps et leur attachement diffère d’une protéine à l’autre. Les chercheurs ont cherché à étudier la sélectivité d’une enzyme spécifique liée au cancer, la N-acétylglucosaminyltransférase-V (GnT-V ou MGAT5).
Le GnT-V est souvent anormalement régulé positivement et peut être un indicateur d’un mauvais pronostic dans les diagnostics de cancer, les N-glycanes étant individuellement associés à des maladies telles que la maladie d’Alzheimer, l’emphysème, le diabète et le cancer. Comprendre pourquoi et comment GnT-V sélectionne les substrats peut offrir des solutions thérapeutiques pour les maladies impliquant cette enzyme.
Le processus de glycosylation des protéines est une modification courante et régulière après leur synthèse et consiste en l’ajout de glucides à la protéine. Il existe deux classes, la N-glycosylation et la O-glycosylation, mais la N-glycosylation est la cible principale de l’étude.
« Les glycanes sont attachés à des tonnes de protéines, et nous savons tous que les structures des glycanes diffèrent légèrement d’une protéine à l’autre. Cela signifie que les enzymes biosynthétiques des glycanes sélectionnent d’une manière ou d’une autre leurs protéines substrats, mais on ne sait absolument pas comment cela se produit », a déclaré Kizuka Yasuhiko, professeur à l’Université de Gifu et auteur de l’étude publiée dans iScience.
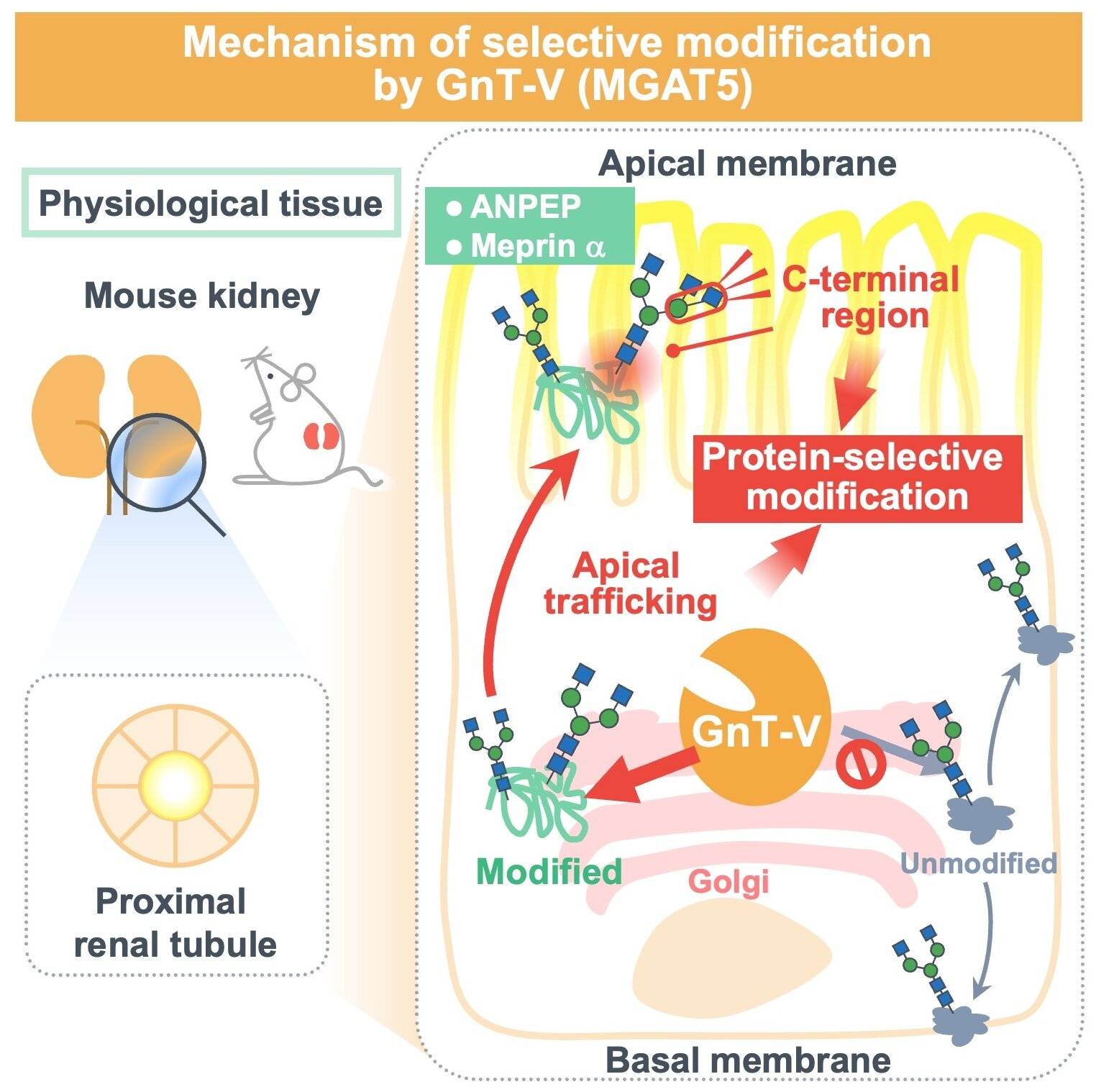
L’étude a révélé la préférence sélective pour le GnT-V basée sur deux facteurs : la structure tridimensionnelle de la protéine et le trafic subcellulaire (le mouvement des molécules au sein d’une cellule) dans les cellules polarisées. Les cellules polarisées comportent deux parties distinctes, séparées par un axe, chacune est responsable de rôles différents et est composée différemment.
Les parties sont souvent appelées basales (en bas) et apicales (en haut). Cependant, cette étude étant menée sur des souris et des tissus rénaux de souris, il n’est pas clair si la sélectivité en ce qui concerne la polarité peut être extrapolée à d’autres tissus organiques.
Deux enzymes spécialisées dans la dégradation des protéines auxquelles sont attachés des ions métalliques (métalloprotéases) ont été identifiées comme les principaux substrats du GnT-V dans le rein, localisées principalement à la surface apicale. La sélection de ces substrats semble reposer principalement sur le trafic dans la partie apicale de la cellule ainsi que sur sa structure. Des éclaircissements supplémentaires sur la manière exacte dont GnT-V sélectionne les substrats sont donc nécessaires pour tirer pleinement parti des connaissances tirées de cette étude.
Outre les recherches futures nécessaires, cette étude présente certaines limites : le recours à une certaine protéine pour identifier les substrats glycoprotéiques du GnT-V laisse place à la possibilité que certaines glycoprotéines soient négligées. De plus, des cellules polarisées (cellules avec deux surfaces distinctes) sont utilisées dans cette étude, et on ne sait pas exactement si la modification du GnT-V dépend de la polarité des cellules.
Malgré les limites, les chercheurs aimeraient poursuivre l’étude pour bien comprendre le mécanisme par lequel les structures des glycanes sont façonnées pour chaque glycoprotéine.
« Cela pourrait conduire à la prédiction précise des structures glycanes de chaque glycoprotéine dans les cellules, contribuant ainsi au remodelage éventuel des glycanes à des fins thérapeutiques », a déclaré Yasuhiko.
Fourni par l’Institut de recherche Glyco-core (iGCORE)