Une équipe de recherche de l’Université d’Osaka, rejointe par le professeur Shimon Sakaguchi, le dernier lauréat du prix Nobel de physiologie ou de médecine, a identifié un sous-ensemble de cellules immunitaires jusqu’alors non caractérisé, appelé cellules régulatrices folliculaires T précurseurs (preTfr), qui jouent un rôle essentiel dans la prévention de la production d’auto-anticorps.
Leur article, « Les cellules régulatrices folliculaires T précurseurs humaines sont préparées pour la différenciation en Tfr matures et perturbées lors d’infections graves », est publié dans Avancées scientifiques.
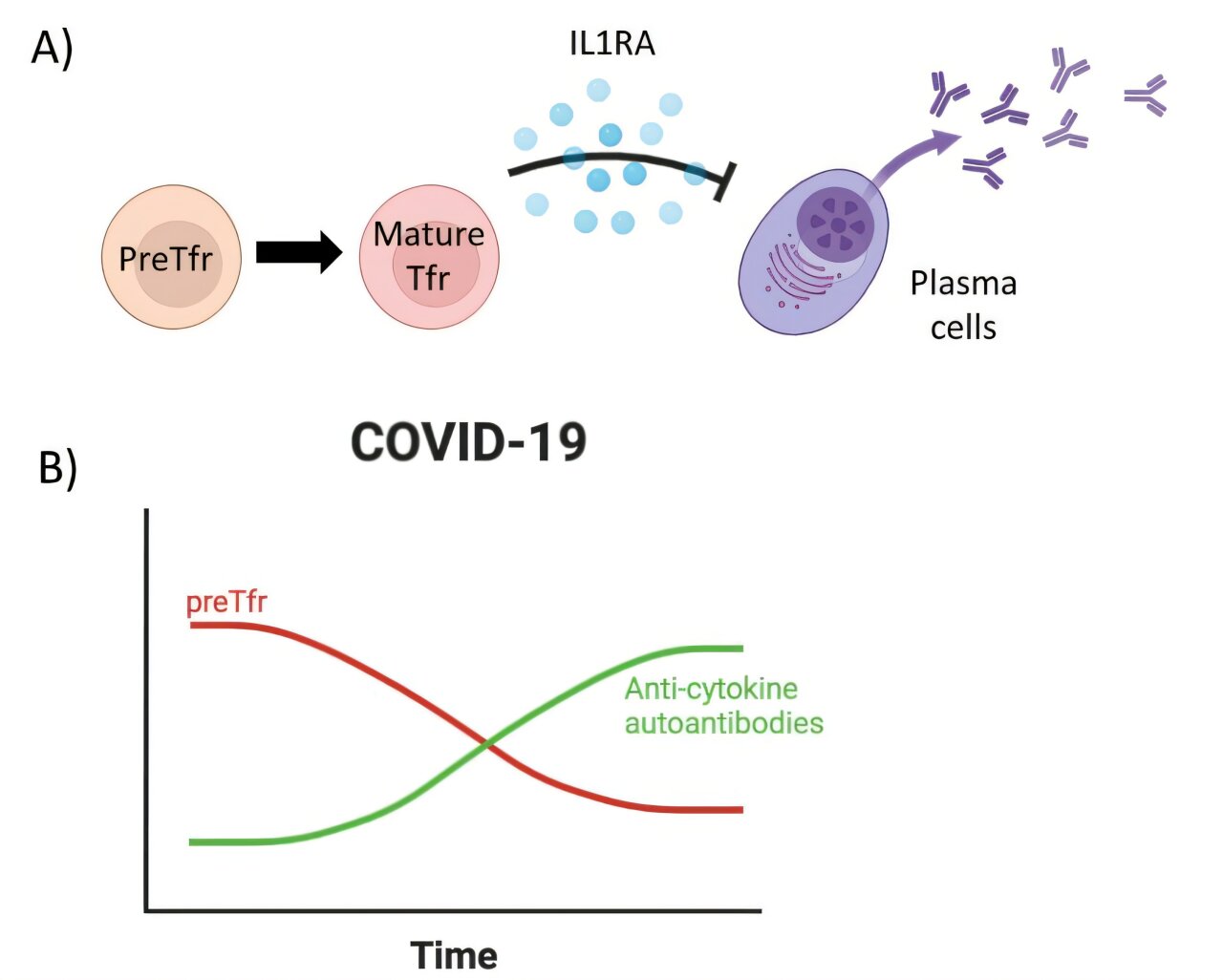
L’étude révèle que ces cellules sont considérablement réduites chez les patients atteints de COVID-19 sévère et de sepsis, et que leur perte est en corrélation avec des niveaux accrus d’auto-anticorps nocifs contre l’interféron gamma.
Les cellules T folliculaires régulatrices (Tfr) sont des cellules immunitaires spécialisées qui contrôlent la production d’anticorps. Même si les chercheurs savaient que les Tfr circulants existaient dans le sang, les étapes de leur développement restaient floues. Cette étude démontre qu’une proportion significative de Tfr en circulation ont un phénotype naïf appelé preTfr, caractérisé par l’expression de CD45RA et CXCR5.
L’équipe de recherche a découvert que les cellules preTfr sont extensibles dans des conditions de laboratoire tout en conservant leur capacité immunosuppressive. Lorsqu’elles sont stimulées, ces cellules augmentent l’expression de molécules suppressives telles que l’IL-1RA, ce qui suggère qu’elles sont prêtes à se différencier en Tfr matures. L’étude a également révélé que les preTfr possèdent une capacité améliorée de cicatrisation des plaies.
Dans les échantillons de sang de patients atteints de COVID-19 sévère, de sepsis bactérien et de témoins sains, le préTfr et le Tfr mature étaient significativement réduits dans le cas du COVID-19 et du sepsis. Les lymphocytes T régulateurs naïfs conventionnels sont restés stables, ce qui indique que les préTfr ont un modèle de réponse distinct lors d’infections graves.
La réduction du preTfr était corrélée à une augmentation des auto-anticorps anti-interféron gamma à la fin du COVID-19. Les patients présentant ces autoanticorps ont également présenté une augmentation des cellules B atypiques activées.
Contrairement à une infection grave, la vaccination par ARNm du SRAS-CoV-2 a augmenté la fréquence des préTfr et des Tfr matures, en particulier après des doses ultérieures, ce qui suggère que les préTfr participent à des réponses immunitaires bien régulées, mais que leur perte lors d’une infection grave entraîne une dérégulation et une production d’anticorps auto-immuns.
« Ces données suggèrent que les Tfr sont perturbés dès le premier stade de leur formation lors d’une maladie grave », explique le Dr James B. Wing, auteur correspondant.
« La découverte de preTfr en tant que sous-ensemble immunitaire distinct a des implications importantes pour comprendre pourquoi certains patients développent des auto-anticorps lors d’infections graves et pourrait fournir de nouvelles cibles thérapeutiques pour les futurs développements de vaccins et traitements des maladies auto-immunes. »